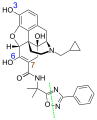纳地美定
 | |
| 临床资料 | |
|---|---|
| 商品名 | Symproic, Rizmoic |
| 其他名称 | S-297,995 |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a617031 |
| 核准状况 | |
| 给药途径 | 口服 |
| ATC码 | |
| 法律规范状态 | |
| 法律规范 |
|
| 药物动力学数据 | |
| 血浆蛋白结合率 | 93–94% |
| 药物代谢 | 主要经由 CYP3A4 |
| 生物半衰期 | 11 hrs |
| 排泄途径 | 尿液、粪便 |
| 识别信息 | |
| |
| CAS号 | 916072-89-4 1345728-04-2(对甲苯磺酸盐) |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| 化学信息 | |
| 化学式 | C32H34N4O6 |
| 摩尔质量 | 570.65 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
纳地美定 (台湾商品名适秘效,美国商品名Symproic ,欧盟地区商品名Rizmoic ),是一种口服末梢性µ型类鸦片受体拮抗剂,用于治疗成年人患有非因癌症所导致之慢性疼痛,因长期使用鸦片类药物所致之便秘。本药物由盐野义制药开发,[1]临床研究发现它对上述适应症的效果具有统计学上的意义,一般来说病人耐受度良好,副作用主要为轻至中度的肠胃道副作用, [2]仅有少数病人发生中枢神经系统鸦片类药物戒断症状,或是影响了同时给予的鸦片类药物的止痛或缩瞳效果。 [3]
医疗用途
[编辑]美国核准纳地美定治疗患有慢性非癌症疼痛的成人,因使用鸦片类药物所导致的便秘,包括因先前的癌症或其治疗相关的慢性疼痛,且不需要频繁增加鸦片类止痛药物剂量的病人。 [3]
在欧盟,纳地美定也被核准治疗成年人因鸦片类药物导致的便秘,作为泻剂治疗后的二线用药。 [4]
禁忌症
[编辑]禁用于肠胃道阻塞或穿孔病人,或有这些问题风险的患者。 [3] [4]
副作用
[编辑]研究时发现的副作用如下:腹痛(用药组发生率8-11%,安慰剂组为 2-5%)、腹泻(7%,安慰剂组2-3%)、恶心(4-6%,安慰剂组2- 5%)、呕吐(3%,安慰剂组2%)、肠胃炎(2-3%,安慰剂组1%),以及鸦片类药物戒断症候群(1.5-3.2% ,对安慰剂组为0.5-1.5%)。后者除一位病人发生严重但可处理的副作用外,皆为轻至中度。超敏反应少见,仅有两位病人。 [3] [4]
过量
[编辑]单次给予高达建议剂量的500倍剂量,以及给予高达推荐剂量的150倍之剂量持续10天,会导致前述副作用增加,但仅为轻度到中度之严重程度。 [3] [4]
交互作用
[编辑]纳地美定主要由肝脏的酵素CYP3A4代谢,故此酵素的抑制剂将增加纳地美定的体内浓度,可能增加其副作用。例如伊曲康唑(增加了纳地美定的暴露量达2.9倍)、酮康唑、克拉霉素和葡萄柚汁。相对地,CYP3A4的诱导剂如利福平和圣约翰草将降低纳地美定在体内的浓度;利福平可降低纳地美定浓度达 83%。 [3] [4]
P-糖蛋白的强抑制剂(如环孢素)可能会增加血浆中的纳地美定浓度。 [3] [4]
药理
[编辑]作用机转
[编辑]纳地美定是纳曲酮的衍生物,并且可阻断μ、δ和κ型鸦片受体。纳地美定因能穿越血脑屏障而可用于治疗鸦片类药物依赖性。但纳地美定因为有巨大的亲水性侧链,以及与P-糖蛋白的亲和力,故纳地美定在中枢神经系统中的浓度极低,反而主要作用于肠胃道的μ型鸦片受体,对抗鸦片类药物导致的便秘。 [4]
药代动力学
[编辑]口服后,纳地美定的绝对生物利用度介于20%至56%,空腹服用0.75小时后(与高量脂肪餐点一起服用 2.5 小时后)达到最高血浆浓度。与实务忆起服用或空腹服用,其药物浓度曲线下面积没有显着差异,因此服药时间与是否空腹无关。本药物进入血液后,93%至94%的与血浆蛋白结合,主要是白蛋白。 [3] [4]
纳地美定主要由CYP3A4代谢为去甲基纳地美定[5](约占循环中本物质的9-13%),部分由UGT1A3代谢为纳地美定3-葡糖苷酸,次要代谢物物包括 6-葡糖苷酸、7-( R/S )-羟基衍生物,以及肠细菌裂解𫫇二唑环形成纳地美定羧酸与苯甲脒。去甲基纳地美定与含葡糖苷酸根和羧酸根的衍生物,也可以拮抗鸦片类受体,但不如原始药物有效。 [6]
-
去甲基纳地美定,主要代谢物
纳地美定及其代谢物经由尿液和粪便排泄。终末半衰期约为11小时。 [4] [6]
化学
[编辑]纳地美定药物为甲苯磺酸盐的形式,呈白至浅褐色粉末状,不吸湿,在生理pH值下具有高水溶性。 [6]
社会与文化
[编辑]临床试验
[编辑]COMPOSE计划是在18-80岁患有慢性非癌症疼痛,但因使用鸦片类药物导致便秘的成年人,所进行的三期临床试验。COMPOSE-I和COMPOSE-II是为12周的随机双盲对照试验,比较纳地美定与安慰剂的效果。COMPOSE-I于2013年8月至2015年1月在七个国家的68家门诊单位进行,而COMPOSE-II于2013年11月开始至2015年6月在六个国家的69个门诊单位进行。在这两项试验中,病人被随机分配接受纳地美定0.2毫克或安慰剂,每天一次,持续12周。治疗有反应的定义为每周至少有3次自发排便,且在12周试验期间的9周中有增加1次自发排便,包括研究最后4周中的3周。在COMPOSE-I和COMPOSE-II中,纳地美定组的反应者比例显着高于安慰剂组。两项试验中的不良事件相似,然而使用纳地美定组患者的不良事件发生率略高。 [7]
COMPOSE-III是为期52周的临床试验,旨在研究纳地美定在非癌症慢性疼痛患者中的长期安全性。结果发现在统计学上病人每周排便增加,且并未有鸦片类药物戒断症状,结论为两组之间的不良反应相似。 [8]
参考
[编辑]- ^ FDA Approves Symproic (naldemedine) for the Treatment of Opioid-Induced Constipation - Chemdiv. Chemdiv. 2017-03-27 [2017-04-05]. (原始内容存档于2017-04-06) (美国英语).
- ^ Shionogi. Research and Development at Shionogi (as of March 2009) (PDF). 2009-03-27 [2012-05-12]. (原始内容 (PDF)存档于2013-05-22).
- ^ 3.0 3.1 3.2 3.3 3.4 3.5 3.6 3.7 FDA专业药物信息 on Symproic.
- ^ 4.0 4.1 4.2 4.3 4.4 4.5 4.6 4.7 4.8 Rizmoic: EPAR – Product information (PDF). European Medicines Agency (EMA). 2019-08-29 [2022-08-25]. (原始内容存档 (PDF)于2021-10-28).
- ^ Ohnishi S, Fukumura K, Kubota R, Wajima T. Absorption, distribution, metabolism, and excretion of radiolabeled naldemedine in healthy subjects. Xenobiotica; the Fate of Foreign Compounds in Biological Systems. September 2019, 49 (9): 1044–1053. PMID 30351180. S2CID 53036507. doi:10.1080/00498254.2018.1536815.
- ^ 6.0 6.1 6.2 Rizmoic: EPAR – Public assessment report (PDF). European Medicines Agency (EMA). 2018-12-14 [2022-08-25]. (原始内容存档 (PDF)于2021-10-28).
- ^ Hale M, Wild J, Reddy J, Yamada T, Arjona Ferreira JC. Naldemedine versus placebo for opioid-induced constipation (COMPOSE-1 and COMPOSE-2): two multicentre, phase 3, double-blind, randomised, parallel-group trials. The Lancet. Gastroenterology & Hepatology. August 2017, 2 (8): 555–564. PMID 28576452. doi:10.1016/S2468-1253(17)30105-X.
- ^ Center for Drug Evaluaiton and Research Medication Review (PDF). FDA. FDA. [31 October 2017]. (原始内容存档 (PDF)于2019-07-02).