1,2-威悌重排反應
外觀
1,2-威悌重排反應指醚在強鹼(如有機鋰試劑)作用下重排為烷氧基化合物。[1][2]
反應由格奧爾格·維蒂希(諾貝爾化學獎得主)和洛曼於1942年首先報道。
這個反應是合成多取代醇的一個較好的方法。
當R''為吸電子基團(如氰基),很容易離去時,該基團在反應中被消除,反應產物是相應的酮類。[3]
反應機理
[編輯]一般認為反應底物醚在強鹼作用下生成的 α-碳負離子發生 O-R 鍵均裂形成自由基中間體,之後自由基1,2-遷移後兩個自由基再偶聯為最終的烷氧基化合物。[4]
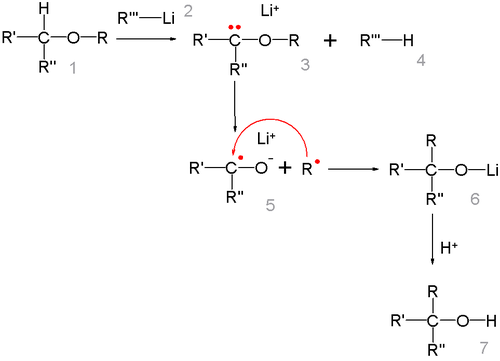
烴基遷移順序與自由基穩定性相吻合,即甲基<伯烴基<仲烴基<叔烴基。
某些烯丙基芳醚也可以按照另一機理進行反應。[4] 例如,下圖中的烯丙基芳醚(1)用仲丁基鋰在−78℃處理得到鋰化中間體(2)。當升高溫度至−25℃,並用三甲基氯矽烷捕獲反應的醇鋰中間體時,結果只得到重排產物(5),沒有(4)生成。這個結果排除了通過自由基(3a)進行反應的機理,支持了以Meisenheimer絡合物(3b)為中間體的反應機理。進一步研究表明烯丙基(對叔丁基苯基)醚進行反應時,反應速率發生下降,從而再次證實了以(3b)為中間體的機理。

參見
[編輯]參考資料
[編輯]- ^ Georg Wittig, L. Löhmann, Ann. 550, 260 (1942)
- ^ G. Wittig, Experientia 14, 389 (1958).
- ^ Preparation of aryl benzyl ketones by [1,2]-Wittig rearrangement Alan R. Katritzky, Yuming Zhang, Sandeep K. Singh Arkivoc p. 146-150 2002 (vii) link (頁面存檔備份,存於網際網路檔案館)
- ^ 4.0 4.1 Wittig Rearrangement of Lithiated Allyl Aryl Ethers: A Mechanistic Study Sven Strunk, Manfred Schlosser European Journal of Organic Chemistry Volume 2006, Issue 19 , Pages 4393 - 4397 doi:10.1002/ejoc.200600304


