特伯試劑
| 特伯試劑 | |
|---|---|
| |

| |
| IUPAC名 μ-Chloro[di(cyclopenta-2,4-dien-1-yl)]dimethyl(μ-methylene)titaniumaluminum | |
| 識別 | |
| CAS號 | 67719-69-1 |
| PubChem | 53384502 |
| ChemSpider | 34981139 |
| SMILES |
|
| InChI |
|
| InChIKey | FHPQZKBPAZOMGO-SBUAZLESAR |
| 性質 | |
| 化學式 | C13H18AlClTi |
| 莫耳質量 | 284.60 g·mol⁻¹ |
| 溶解性(有機溶劑) | 甲苯、苯、二氯甲烷、 THF (僅在低溫時) |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
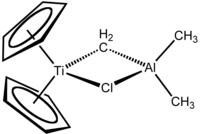
特伯試劑是化學式為(C5H5)2TiCH2ClAl(CH3)2的有機金屬化合物,被用於羰基的亞甲基化反應[1]。特伯試劑是紅色固體,在空氣中會自燃,因此需要在無空氣體系中使用。由杜邦中央研究院的弗雷德里克·奈·特伯最早合成,並由此得名。
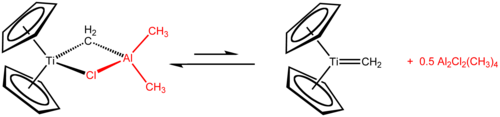
特伯試劑包含一對橋連配體連接的兩個四面體金屬中心,鈦上有兩個環戊二烯基([C
5H
5]−
),鋁上有兩個甲基。鈦和鋁通過亞甲基橋(-CH2-)和氯原子以四邊形的(Ti–CH2–Al–Cl)幾何結構相連[2]。特伯試劑是第一個被報告的由亞甲基橋連過渡金屬和主族金屬的化合物[3]。
製備
[編輯]特伯試劑可以由二氯二茂鈦和三甲基鋁在甲苯中合成[3][4]:
- Cp2TiCl2 + 2 Al(CH3)3 → CH4 + Cp2TiCH2AlCl(CH3)2 + Al(CH3)2Cl
反應約三天後,重結晶去除Al(CH3)2Cl [3]後得到產物。儘管使用分離的特伯試劑進行有機合成會得到更純淨的產物,但特伯試劑的原位合成也已經被報道[5][6],僅需要在加入起始原料前將溶液放在冰浴或乾冰浴中即可。
另一種更麻煩的可選合成方法是是使用二甲基二茂鈦(Petasis試劑)來合成[7]:
- Cp2Ti(CH3)2 + Al(CH3)2Cl → Cp2TiCH2AlCl(CH3)2 + CH4
該反應不僅需要複雜的原料,而且還難以將產物分離。
反應機理
[編輯]特伯試劑不會直接與羰基反應,必須先使用溫和的路易斯鹼處理(如吡啶)得到活性的Schrock卡賓。
類似於威悌試劑,反應可能是Ti (IV)的親氧性驅動的。Schrock卡賓(1)與羰基化合物(2)反應生成推測的四元環中間體(3),這一中間體從未被分離,因為它會立刻分解為對應的烯烴(5)。
應用
[編輯]特伯試劑可以用於有機合成中的羰基亞甲基化[8][9][10],這一操作同樣可以用威悌試劑實現,但特伯試劑對空間位阻羰基更有效。此外,特伯試劑鹼性更弱,不會產生β-消除產物。
特伯試劑可以將醛、內酯、醯胺亞甲基化,將酯變為對應的烯醇醚,將醯胺變為對應的烯胺。在同時含有酯和酮的化合物中,特伯試劑可以選擇性地還原酮羰基[11],但鄰近基團的空間位阻也會影響反應的選擇性。
特伯試劑的亞甲基化反應不會將手性α-C外消旋,從而得以保持其立體化學構型,因此在糖類化合物的反應中有重要作用[12]。
特伯試劑可以與醯氯反應,取代氯得到烯醇鈦化合物。
參見
[編輯]相關有機鈦試劑及反應
[編輯]相關亞甲基化試劑及反應
[編輯]參考文獻
[編輯]- ^ F. N. Tebbe, G. W. Parshall and G. S. Reddy. Olefin homologation with titanium methylene compounds. J. Am. Chem. Soc. 1978, 100 (11): 3611–3613. doi:10.1021/ja00479a061.
- ^ Thompson, Rick; Nakamaru-Ogiso, Eiko; Chen, Chun-Hsing; Pink, Maren; Mindiola, Daniel J. Structural Elucidation of the Illustrious Tebbe Reagent. Organometallics. 2014, 33 (1): 429–432. doi:10.1021/om401108b.
- ^ 3.0 3.1 3.2 Herrmann, W.A., "The Methylene Bridge" Advances in Organometallic Chemistry 1982, 20, 195–197.
- ^ Straus, D. A., "μ-Chlorobis(cyclopentadienyl)(dimethylaluminium)-μ-methylenetitanium": Encyclopedia of Reagents for Organic Synthesis. John Wiley, London, 2000.
- ^ Pine, S. H.; Kim, V.; Lee, V. Enol ethers by methylenation of esters: 1-Phenoxy-1-phenylethene and 3,4-dihydro-2-methylene-2H-1-benzopyran. Org. Synth. 1990, 69: 72. doi:10.15227/orgsyn.069.0072.
- ^ L. F. Cannizzo; R. H. Grubbs. In situ preparation of (μ-chloro)(μ-methylene)bis(cyclopentadienyl)(dimethylaluminum)titanium (Tebbe's reagent). J. Org. Chem. 1985, 50 (13): 2386–2387. doi:10.1021/jo00213a040.
- ^ Payack, J. F.; Hughes, D. L.; Cai, D.; Cottrell, I. F.; Verhoeven, T. R. (2004). "Dimethyltitanocene". Org. Synth.; Coll. Vol. 10: 355.
- ^ Hartley, Richard C.; Li, Jianfeng; Main, Calver A.; McKiernan, Gordon J. Titanium carbenoid reagents for converting carbonyl groups into alkenes. Tetrahedron. 2007, 63 (23): 4825–4864. doi:10.1016/j.tet.2007.03.015.
- ^ Pine, S. H. Org. React. 1993, 43, 1. (Review)
- ^ Beadham, I.; Micklefield, J. Curr. Org. Synth. 2005, 2, 231–250. (Review)
- ^ Bunch, L; Liljefors, T; Greenwood, J. R; Frydenvang, K; Brauner-Osborne, H.; Krogsgaard-Larsen, P.; Madsen, U. Rational Design, Synthesis, and Pharmacological Evaluation of 2-Azanorbornane-3-exo,5-endo-dicarboxylic Acid: A Novel Conformationally Restricted Glutamic Acid Analogue 68: 1489. 2003. doi:10.1021/jo026509p.
- ^ A. Marra, J. Esnault, A. Veyrieres and P. Sinay. Isopropenyl glycosides and congeners as novel classes of glycosyl donors: theme and variations. J. Am. Chem. Soc. 1992, 114 (16): 6354–6360. doi:10.1021/ja00042a010.
- ^ Luciano Lombardo. Methylenation of Carbonyl Compounds: (+)-3-Methylene-cis-p-menthane. Organic Syntheses. 1987, 65: 81. doi:10.15227/orgsyn.065.0081..