锿
锿是在1952年第一次氢弹爆炸的残余物中发现的,并以物理学家阿尔伯特·爱因斯坦命名。其最常见的同位素为锿-253(半衰期为20.47天),是通过锎-253的衰变而人工制造的,每年在高能核反应堆中的产量约为1毫克。合成之后,锿-253要从其他锕系元素及其衰变产物中分离出来,这是个复杂的过程。其他的锿同位素则在各个实验室中以较轻元素的离子撞击锕系元素而合成,但产量少得多。由于锿的产量少,且最容易生产的锿-253半衰期又较短,目前锿在基础科学研究之外几乎没有任何应用。锿曾在1955年用于首次合成钔元素,并一共合成了17颗钔原子。
锿是一种十分活泼的柔软银白色金属,具顺磁性。其化学属性符合典型的重锕系元素,容易形成+3氧化态,但在固相中也可以形成+2态。锿-253的高放射性会使它明显地发光,并会迅速破坏其晶体金属结构,每克释放大约1000焦耳的热量。由于锿-253每天都损失3%的质量,并依次衰变为锫和锎,因此对锿的研究十分困难。寿命最长的锿同位素是锿-252(半衰期为471.7天),可以用于研究锿的物理特性,但生产锿-252是极为困难的,每次的产量也极少。[2]锿是最后一种曾在宏观尺度下以纯元素形态被研究过的元素,即产量能以肉眼所见的最重元素,所用的同位素是较常见但半衰期短的锿-253。[3]和其他的人工合成的超铀元素一样,锿极具放射性,与其接触会对健康造成损害。[4]
历史
[编辑]

锿在1952年12月由阿伯特·吉奥索等人于伯克利加州大学连同阿贡国家实验室和洛斯阿拉莫斯国家实验室合作发现。含有锿的样本采自“常春藤麦克”核试验的辐射落尘。该核试验于1952年11月1日在太平洋埃内韦塔克环礁上进行,是首次成功引爆的氢弹。[5]对爆炸落尘的初步检验发现了一种新的钚同位素(
244
94Pu
),而这只能通过铀-238吸收6颗中子,再进行两次β−衰变才会形成[6]。
当时一般认为,重原子核多次吸收中子是一件较罕见的现象,但244
94Pu
的形成意味着铀原子核可能会捕获更多的中子,从而产生比锎更重的元素。[5]
飞机搭载滤纸飞过爆炸残余的云,滤纸再交由吉奥索等人进行分析(244
94Pu
也是用同一种方法发现的)。[7]在核试验进行地点埃内韦塔克环礁处受污染的珊瑚礁也被送到美国进行处理及分析,从中又提取了更多放射性物质。[5]疑似新元素的分离是在微酸性(pH ≈ 3.5)的柠檬酸/铵缓冲溶液中利用离子交换法在高温下进行的。最后得出的锿元素只有不到200个原子。[8]不过,通过发现253Es的特征性α衰变能量(6.6 MeV),还是能够探测到锿的存在。[5]该同位素是在铀-238原子核捕获了15颗中子,再经过7次β衰变后形成的,半衰期为20.5天。之所以能够有这样多次的中子捕获,是因为核爆时所产生的高中子通量,使新产生的同位素能够在衰变为较轻的元素之前吸收大量的中子。中子捕获最初只会提高该核素的质量数(中子数加质子数),而不会提高其原子序(质子数);之后的β衰变再依序增加原子序:[5]
某些238U更能够另外再吸收两颗中子(一共17颗),形成255Es,以及255Fm。镄(Fm)是在本次核试验中发现的另一种新元素。[注 1]由于正值冷战时期,因此这些新元素的发现被美国军方列为机密,直到1955年才被公布。[5][9][10]这样的快速多次中子捕获使R-过程有了所需的实验验证。R-过程是一种多次中子捕获的过程,能够解释某些重元素(镍以上元素)是如何在超新星爆炸中合成的,这是宇宙中许多稳定元素的来源。[11]
同时,位于伯克利及阿贡的实验室利用氮-14和铀-238之间的核反应[12]以及对钚和锎进行强烈的中子辐射,也产生了锿(和镄)的一些同位素:
研究结果在1954年发布。报告中附有声明,注明此前已有过对这些元素进行的研究。[13][14][15][16][17]伯克利的研究团队也发布了有关锿和镄化学属性的研究结果。[18][19]有关“常春藤麦克”核弹的研究在1955年解密。[9]
与美国团队竞争的,有位于瑞典斯德哥尔摩的诺贝尔物理研究所。1953年末至1954年初,该团队以氧原子核撞击铀原子核,成功合成了较轻的一些镄同位素,如250Fm。这些结果也在1954年发布。[20]但是,由于发布日期较早,所以人们一般还是承认伯克利团队最先发现锿元素。该团队因此拥有对该元素的命名权。他们决定将第99号元素命名为Einsteinium,以纪念逝世不久的阿尔伯特·爱因斯坦(Albert Einstein,1955年4月18日逝);并将第100号元素命名为Fermium,以纪念另一位逝世不久的物理学家恩里科·费米(Enrico Fermi,1954年11月28日逝)。[注 2][9]1955年8月8日至20日于第一届日内瓦原子会议(Geneva Atomic Conference)上,阿伯特·吉奥索首次宣布发现这些新元素。[5]锿的最初符号为“E”,后改为“Es”。[21][22]
特性
[编辑]物理特性
[编辑]
锿是一种银白色的放射性金属。在元素周期表中,锿位于锎之右,镄之左,钬之下。其物理及化学特性与钬有许多共通之处。其密度为8.84 g/cm3,这比锎的密度低(15.1 g/cm3),但与钬的密度相约(8.79 g/cm3)。锿的熔点(860 °C)比锎(900 °C)、镄(1527 °C)及钬(1461 °C)的熔点低。[4][24]锿是一种柔软的金属,其体积模量只有15 GPa,是非碱金属中该数值最低的元素之一。[25]
与更轻的锕系元素锎、锫、锔及镅不同的是,锿不呈双六方晶体结构,而是呈面心立方结构。其空间群为Fm3m,点阵常数为a = 575 pm。但是有研究称,锿能够在室温下形成六方晶体,a = 398 pm,c = 650 pm,但在加热到300 °C之后便转变为面心立方结构。[26]
锿的放射性非常强,使其自身的晶体结构迅速受辐射破坏;[27]每克253Es会通过辐射释放1000瓦的能量,足以产生肉眼可见的亮光。[28]这也可能是锿拥有低密度、低熔点的原因。[29]由于可用样本稀少,所以锿的熔点是通过观察在电子显微镜下对锿进行加热而推导出的。[30]少量样本中的表面效应会降低熔点值。
锿的化合价为三,而且具高挥发性。[31]为了减少辐射对锿自身的破坏,大部分对固体锿及其化合物的测量都在热退火之后马上进行。[32]某些锿化合物是在还原性气体中研究的,如H2O+HCl用于研究EsOCl,这样化合物在分解的同时,也会重新形成。[33]
除了辐射导致的自我破坏以外,锿的稀少和迅速衰变也对研究造成了困难。最常见的同位素253Es每年只生产一到两次,每次分量不超过1毫克。每1天有3.3%的锿转变为锫,再转变为锎:[34][35][36]
因此大部分被研究的锿样本都受到了其他物质的污染,而其本身的属性则是通过长期积累数据推导而得。其他避过污染问题的实验方法包括用可调谐镭射选择性地只激发锿离子,这种方法被用于研究锿的发光属性。[37]
对锿金属、其氧化物及氟化物磁性的研究指出,这三种物质从在液态氢中到室温中均显示出居里外斯顺磁性。推导出的Es2O3的有效磁矩为10.4 ± 0.3 µB,EsF3的为11.4 ± 0.3 µB。这两个值是锕系元素中最高的,相对应的居里点分别为53和37 K。[38][39]
化学特性
[编辑]和所有锕系元素一样,锿在化学上非常活泼。其+3氧化态在固体及水溶液中最为稳定,并呈浅粉红色。[40]在固体中,锿还可以形成+2态。这种+2态在许多别的锕系元素中是不存在的,包括镤、铀、镎、钚、锔和锫。Es2+化合物可以通过使用二氯化钐还原Es3+来取得。[41]气态化学研究臆测可能存在+4态,但这仍待证实。[42]
同位素
[编辑]锿已知共有18种同位素及5种同核异构体,质量数从240到257不等[43],全部都具有放射性,其中最稳定的同位素为252Es,半衰期为471.7天。[44]其他较稳定的同位素包括254Es(半衰期为275.7天)、[45]255Es(39.8天)及253Es(20.47天)。其余所有的同位素半衰期都在40小时以下,大部分的在30分钟以下。5种同核异构体中,最稳定的为254mEs,其半衰期为39.3小时。[43]
核裂变
[编辑]锿具有高核裂变率,因此要持续核链式反应所需的临界质量很低。一个纯254Es同位素球体的临界质量为9.89公斤,只要加上一条30厘米长的钢条或水反射层就能把临界值降到2.9甚至2.26公斤。然而,这一数值远比目前总共制造出的锿元素要多,其中254Es的总产量则更少。[46]
天然存量
[编辑]由于锿的所有同位素半衰期都很短,所以一切原始的锿核素,也就是在地球形成时可能存在的锿,至今都已全部衰变殆尽。锿也可以通过地壳中的锕系元素(铀和钍)发生多次中子捕获产生,但这发生的可能性极低。因此地球上几乎所有的锿都是在科学实验室、高能核反应堆或是核武器试验中产生的,并在合成后只存留不超过几年的时间。[8]从95号镅至100号镄的超铀元素,包括锿,都曾位于加蓬奥克洛的天然核反应堆中自然产生,但至今已不再形成了。[47]
合成与提取
[编辑]
锿是在核反应堆中通过对锕系元素进行中子撞击而产生的。锿元素的主要来源是位于美国田纳西州橡树岭国家实验室的85 MW高通率同位素反应堆(HFIR),[49]以及位于俄罗斯季米特洛夫格勒核反应器研究所(NIIAR)的SM-2环流反应器。[50]这两个反应器都是专门用于制造超锔元素的(Z > 96)。两座设施的功率和通量相约,所以两者对超锔元素的生产量应该是相约的,[51]但文献较少报导NIIAR所生产的超锔元素。该实验室通过对锔进行辐射,一般每次可生产数十克(1×101 g)锎、数毫克(1×10-3 g)锫和锿以及数皮克(1×10-12 g)镄。[52][53]
HFIR在1961年首次制成微量的253Es,样本大约重10纳克(1×10-9 g)。研究人员使用了一种特殊的磁秤来估计样本的重量。[4][54]之后的单次产量增加到1967年至1970年的0.48毫克,然后到1971年至1973年的3.2毫克,再到1974年至1978年的每年3毫克产量。[55]这些数值指的是刚刚完成辐射时的锿元素总量,而接着的分离过程会将纯锿的量降低大约10倍。[51]
在实验室中合成
[编辑]对钚进行强烈的中子辐射能够产生4种锿同位素:253Es(α衰变半衰期为20.03天,自发裂变半衰期为7×105年)、254mEs(β衰变半衰期为38.5小时)、254Es(α衰变半衰期为276天)及255Es(β衰变半衰期为24天)。[56]另一种合成方式是以氮离子或氧离子高强度撞击铀-238。[57]
锿-247(半衰期为4.55分钟)是以碳离子撞击镅-241,或以氮离子撞击铀-238产生的。[58]后者在1967年于俄罗斯杜布纳进行,参与的科学家因此获得了列宁共青团奖。[59]
同位素248Es是以氘离子撞击249Cf产生的。它主要以放射正电子的形式进行衰变,成为248Cf,半衰期为25 ± 5分钟;它也会进行能量为6.87 MeV的α衰变,释放的电子数大约是α粒子数的400倍。[60]
较重的同位素249Es、250Es、251Es和252Es能够通过对249Bk照射α粒子而产生。这种过程会释放1到4颗中子,所以可以用来同时合成4中不同的同位素。[61]
锿-253是通过对0.1至0.2毫克的252Cf目标进行热中子照射产生的,中子通量为每秒每平方厘米2至5×1014颗中子,照射时长为500至900个小时:[62]
在核爆炸中合成
[编辑]
对1千万吨级核弹“常春藤麦克”的辐射落尘所进行的分析是一项长期项目,其目的为研究在高能核爆中超铀元素的生产效率。使用核爆的原因如下:把铀转变成超铀元素需要多重中子捕获,而捕获概率随中子通量的提升而增加。核爆炸是最强的中子源,每微秒每平方厘米能够产生1023个中子(约1029中子/(cm²·s))。相比之下,高通率同位素反应堆的中子通量也只有5×1015中子/(cm²·s)。埃内韦塔克环礁爆炸处随即设立起了一座实验室,以对辐射落尘进行初步分析,因为某些同位素在被送到美国本土之前,便可能已经衰变殆尽了。飞机带着滤纸在核爆之后飞过环礁的上空,并把采回的样本立即送往该实验室。起初,人们希望能够以此发现比镄更重的元素,但在1954年至1956年于该环礁进行了一系列百万吨级核试验之后,却仍没有发现这些元素。[7]
由于相信在局限空间内的核爆可能会增加产生重元素的可能性,因此内华达试验基地(现内华达国家安全区)又在1960年代进行地底核试验,并采集数据。除了一般的铀之外,核弹还装有镅和钍与铀的混合物,以及钚与镎的混合物。试验结果产量偏少,因为装载的重元素提高了裂变率,并导致较重同位素的流失。对产物的提取分离非常困难,因为原子尘分布在地下300至600米处熔化及汽化了的岩石中,而到如此的深度钻地取样又缺乏效率。[7][63]
在1962至1969年间进行的9次地底核试验中,[64]最后一次的规模最大,而其超铀元素产量也最高。在产量与原子质量数的关系图(左图)中,质量较低并拥有奇数质量数的同位素有较低的产量,因而在图中产生锯齿形的曲线。这是因为拥有奇数核子的同位素有较高的裂变率。[63]研究中最大的问题在于采集爆炸后散落在各处的辐射落尘。载有滤纸的飞机只吸附到总量的4×10-14,而在埃内韦塔克环礁处所采集到的量也只增加了两个数量级。在“Hutch”核试验60天后提取的500公斤岩石当中也只有总量的10−7。这500公斤岩石,相比在爆炸7天后取得的0.4公斤石块,其含超铀元素的量只不过高出30倍。这证明超铀元素的量与收集的岩石重量是不成正比的。[65]为了加快样本采集的速度,人们在核试验之前就在爆炸原点钻出了若干个竖井,这样爆炸就会把足够的样本从中心通过竖井带到地表,方便采样。该方法在“Anacostia”和“Kennebec”核试验中得到尝试,并立即为研究提供了数百公斤的物质,但是其中锕系元素的浓度比通过钻地取得的样本的少三倍。这种方法虽然能够有效帮助研究存留时间短的同位素,但却无法提高整体锕系元素的产量。[66]
尽管这一系列核试验没有再产生新的元素(除锿和镄外),而所取得的超铀元素量也不如理想,但是其总体产生的稀有重同位素的量却仍然比此前实验室中能够合成的要多。在“Hutch”核试验中取得的包括大量稀有的250Cm同位素,这是很难从249Cm产生的:249Cm的半衰期(64分钟)相对需数个月时间的反应堆辐射来说太短,但对于核爆炸时间段来说就很长了。[67]
分离
[编辑]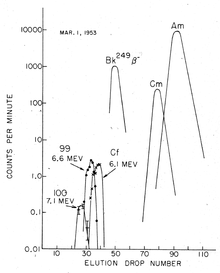
不同的锿合成方式需要相应的分离程序。如果使用回旋加速器使轻离子对重离子进行撞击,那么重离子目标体是固定在金属薄片上的,因此产生的锿在辐射完毕后只需要从薄片上冲洗下来。不过这种方法的锿产量相对较低。[68]使用反应器辐射法能够大大提高产量,但产物将会混有各种锕系元素的同位素,以及核裂变产生的镧系元素。从这种混合物中分离锿元素是个非常繁复的过程,须在高温高压下重复进行正离子交换,再进行色谱法。锿与锫的分离是非常重要的,因为在核反应器中产生的最稳定的锿同位素253Es会衰变为249Bk,半衰期只有20天。这对于多数实验来说都是个很短的时间段。要分离它们就需要用到锫的化学特性:锫能够轻易地氧化成为+4态的固体,并从溶液中沉淀出来;其他的锕系元素,包括锿,则会在溶液中保持其+3氧化态。[69]
要在衰变产物中把三价的锕系元素从镧系元素中分离出来,可以使用正离子交换树脂柱,并注入含有90%水及10%乙醇的氢氯酸饱和溶液,作为洗提剂。其后一般使用负离子交换层析法,所用的洗提剂是浓度为6 M的氢氯酸。最后再以经铵盐处理过的正离子交换树脂柱(Dowex-50交换柱)来分离含有99、100及101号元素的分析层。根据洗提位置随时间的变化,就可以辨认这几个元素,可用的洗提剂包括α-羟基异丁酸溶液(α-HIB)。[70]
对三价锕系元素的分离也可以通过溶剂萃取层析法进行,使用二(2-乙基己基)磷酸酯(简称HDEHP)作为静止的有机相态,并使用硝酸作为流动的水溶相态。锕系元素的洗提顺序与使用正离子交换树脂柱时的顺序相反。以这种方法分离出来的锿不含有机络化剂,而使用树脂柱分离的锿则会含有机络化剂。[70]
锿金属的制备
[编辑]锿是一种高活性元素,因此要从锿化合物中提取纯锿金属,须要使用强还原剂。[71]其中一种方法是使用锂来还原三氟化锿:[72]
- EsF3 + 3 Li → Es + 3 LiF
但是,由于熔点很低,而且其辐射也会迅速破坏其自身结构,所以锿的蒸气压比氟化锂还要高。这大大降低了这条反应的效率。早期的制备程序中曾尝试用过这种方法,但研究人员很快就转用镧金属来还原三氧化二锿:[26][29][73]
- Es2O3 + La → 2 Es + La2O3
化合物
[编辑]| 化合物 | 颜色 | 对称性 | 空间群 | 编号 | 皮尔逊符号 | a(pm) | b(pm) | c(pm) |
|---|---|---|---|---|---|---|---|---|
| Es2O3 | 无色 | 立方晶系[35] | Ia3 | 206 | cI80 | 1076.6 | ||
| Es2O3 | 无色 | 单斜晶系[74] | C2/m | 12 | mS30 | 1411 | 359 | 880 |
| Es2O3 | 无色 | 六方晶系[74] | P3m1 | 164 | hP5 | 370 | 600 | |
| EsF3 | 六方晶系[34] | |||||||
| EsF4 | 单斜晶系[75] | C2/c | 15 | mS60 | ||||
| EsCl3 | 橙色 | 六方晶系[76][77] | C63/m | hP8 | 727 | 410 | ||
| EsBr3 | 黄色 | 单斜晶系[78] | C2/m | 12 | mS16 | 727 | 1259 | 681 |
| EsI3 | 琥珀色 | 六方晶系[79][80] | R3 | 148 | hR24 | 753 | 2084 | |
| EsOCl | 四方晶系[79][81] | P4/nmm | 394.8 | 670.2 |
氧化物
[编辑]三氧化二锿(Es2O3)呈无色立方晶体,可通过燃烧硝酸锿(III)燃烧制成。其首次被研究时的量只有数微克,晶体大小约为30纳米。[27][35]该氧化物还有其他两种相态,结构分别属于单斜晶系及六方晶系。Es2O3形成时的相态取决于其制备方式,目前还没有相关的相态图。在锿的自我辐射及加热下,三种相态会自发互相转变。[82]其六方晶系的相态与三氧化二镧同型:Es3+离子被O2–离子以六配位的形式包围。[74][79]
卤化物
[编辑]
锿的卤化物具有+2及+3氧化态。[81][83]从锿的氟化物到碘化物,+3态最稳定的。
将氟离子注入三氯化锿溶液,可以沉淀出三氟化锿(EsF3)。另一种制备方法是在1至2个大气压及300至400 °C温度下,让三氧化二锿与三氟化氯(ClF3)或与氟气(F2)进行反应。EsF3的晶体结构属于六方晶系,与三氟化锎(CfF3)同型,其中的Es3+离子被氟离子以八面体八配位的形式包围。[34][84][85]
三氯化锿(EsCl3)的制备方式是在约500 °C的干氯化氢气体中对三氧化二锿进行退火20分钟。在温度降到大约425 °C 时,它就会开始结晶成一种橙色的固体。其晶体结构属于六方晶系,与三氯化铀同型,其中的锿原子被氯原子以三帽三角菱柱九配位的形式包围。[77][84][86]三溴化锿(EsBr3)是一种浅黄色固体,晶体结构属于单斜晶系,与三氯化铝同型,其中的锿原子被溴原子以八面体六配位的形式包围。[80][84]
锿的二价化合物可以通过用氢对其三价卤化物进行还原而取得:[87]
- 2 EsX3 + H2 → 2 EsX2 + 2 HX, X = F, Cl, Br, I
人们已制成了二氯化锿(EsCl2)、[88]二溴化锿(EsBr2)、[89]及二碘化锿(EsI2)[81],并对各个分别进行了光吸收特性的判定。目前没有有关其结构的资料。[80]
已知的卤氧化物包括EsOCl、[81]EsOBr[87]及EsOI。[81]其制成方式是将三卤化物置于水和相应卤化氢的混合气体中,使其进行反应。例如,EsCl3 + H2O/HCl可产生EsOCl。[33]
有机化合物
[编辑]锿的高放射性有用于放射性疗法的潜力。科学家曾合成锿的有机络合物,从而将锿原子带到身体中指定的器官里。曾经有实验把柠檬酸锿(以及镄化合物)注射到狗的体内。[28]Es3+也被加入到β-二酮螯合物中,因为在紫外线照射下,镧系元素的β-二酮螯合物在所有金属有机化合物中拥有最强的冷发光效应。当制备锿络合物时,要用Gd3+把Es3+稀释1000倍。这样可以降低化合物被自身辐射破坏的程度,使化合物能够在实验所需的20分钟内不至于瓦解。Es3+发光的强度太弱,因此未能被探测到。这是因为化合物中各部分的相对能量不理想,所以螯合物框架不能有效地把能量传递到Es3+离子中。在换成镅、锫及镄元素后,实验有相同的结果。[90]
Es3+离子的发光效应却在无机氢氯酸溶液及含有二(2-乙基己基)正磷酸的无机溶液中被观测到。波长峰值位于1064纳米(半值宽度为100纳米),可经由绿光照射来激发(约495纳米波长)。发光持续数微秒,量子产额低于0.1%。Es3+的非辐射衰变率比镧系元素的高,而这是由于Es3+的f轨道电子与内层电子间具有较强的相互作用。[91]
应用
[编辑]锿除了在基础科学研究中用于制造原子序更高的超铀元素之外,没有任何实际用途。[92]
1955年,劳伦斯伯克利国家实验室用回旋加速器对约109个253Es原子进行辐射,从而制造出钔。所用的反应253Es(α,n)256Md产生了17个钔原子(原子序为101)。[93]
稀有的锿-254同位素常被用于制造超重元素,因为它质量高,半衰期较长(270天),每次可取得的量也很高(数微克)。[94]故此,在1985年,位于美国加州伯克利的superHILAC直线加速器使用了锿-254来合成Uue(119号元素)。他们以钙-48离子撞击锿-254目标体,但没有探测到任何Uue原子。这为反应截面设下了300纳靶恩的上限。[95]
- 无原子
锿-254曾用于校准勘测者5号月球登陆器上的化学分析光谱仪(见α-散射表面分析仪)。由于该同位素的质量很高,因此月表上轻元素与锿-254同位素在分析仪上的信号重叠会大大减少。[96]
安全
[编辑]有关锿毒性的数据主要来自对动物的研究。当老鼠进食了锿以后,只有大约0.01%的锿进入了血液。进入血液的锿中有65%进入了骨骼,并存留大约50年;25%进入了肺部,生物半衰期约为20年。但由于锿本身半衰期更短,所以这些数值是没有实际关系的。另外0.035%进入了睾丸或0.01%进入卵巢,并永久存留。进食的量中大约10%被排放出来。锿在骨骼表面均匀分布,这和进食了钚后的结果相同。[97]
备注
[编辑]参考资料
[编辑]- ^ 锿和镄. 元素的发现. 南京大学化学实验教学中心. [2016-12-02]. (原始内容存档于2017-09-03).
- ^ production problem of Es-252. [2013-02-24]. (原始内容存档于2007-08-23).
- ^ Haire, Richard G. Fermium, Mendelevium, Nobelium and Lawrencium. Morss; Edelstein, Norman M.; Fuger, Jean (编). The Chemistry of the Actinide and Transactinide Elements 3rd. Dordrecht, The Netherlands: Springer Science+Business Media. 2006. ISBN 1-4020-3555-1.
- ^ 4.0 4.1 4.2 Hammond C. R. "The elements" in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ 5.0 5.1 5.2 5.3 5.4 5.5 5.6 Ghiorso, Albert. Einsteinium and Fermium. Chemical and Engineering News. 2003, 81 (36) [2013-02-24]. (原始内容存档于2018-09-06).
- ^ PERIODIC TABLE OF ELEMENTS: LANL Plutonium. Los Alamos National Security, LLC for the U.S. Department of Energy's NNSA. [2016-12-02]. (原始内容存档于2019-02-12).
- ^ 7.0 7.1 7.2 Seaborg, p. 39
- ^ 8.0 8.1 John Emsley Nature's building blocks: an A-Z guide to the elements (页面存档备份,存于互联网档案馆), Oxford University Press, 2003, ISBN 978-0-19-850340-8 pp. 133–135
- ^ 9.0 9.1 9.2 Ghiorso, A.; Thompson, S.; Higgins, G.; Seaborg, G.; Studier, M.; Fields, P.; Fried, S.; Diamond, H.; Mech, J. New Elements Einsteinium and Fermium, Atomic Numbers 99 and 100. Phys. Rev. 1955, 99 (3): 1048–1049 [2013-02-24]. Bibcode:1955PhRv...99.1048G. doi:10.1103/PhysRev.99.1048. (原始内容存档于2021-05-19). Google Books (页面存档备份,存于互联网档案馆)
- ^ Fields, P.; Studier, M.; Diamond, H.; Mech, J.; Inghram, M.; Pyle, G.; Stevens, C.; Fried, S.; Manning, W. Transplutonium Elements in Thermonuclear Test Debris. Physical Review. 1956, 102: 180–182. Bibcode:1956PhRv..102..180F. doi:10.1103/PhysRev.102.180. Google Books (页面存档备份,存于互联网档案馆)
- ^ Byrne, J. Neutrons, Nuclei, and Matter, Dover Publications, Mineola, NY, 2011, ISBN 978-0-486-48238-5 (pbk.) pp. 267.
- ^ Ghiorso, Albert; Rossi, G. Bernard; Harvey, Bernard G. and Thompson, Stanley G. Reactions of U-238 with Cyclotron-Produced Nitrogen Ions. Physical Review. 1954, 93 (1): 257. Bibcode:1954PhRv...93..257G. doi:10.1103/PhysRev.93.257.
- ^ Thompson, S. G.; Ghiorso, A.; Harvey, B. G.; Choppin, G. R. Transcurium Isotopes Produced in the Neutron Irradiation of Plutonium. Physical Review. 1954, 93 (4): 908. Bibcode:1954PhRv...93..908T. doi:10.1103/PhysRev.93.908.
- ^ Harvey, Bernard; Thompson, Stanley; Ghiorso, Albert; Choppin, Gregory. Further Production of Transcurium Nuclides by Neutron Irradiation. Physical Review. 1954, 93 (5): 1129. Bibcode:1954PhRv...93.1129H. doi:10.1103/PhysRev.93.1129.
- ^ Studier, M.; Fields, P.; Diamond, H.; Mech, J.; Friedman, A.; Sellers, P.; Pyle, G.; Stevens, C.; Magnusson, L. Elements 99 and 100 from Pile-Irradiated Plutonium. Physical Review. 1954, 93 (6): 1428. Bibcode:1954PhRv...93.1428S. doi:10.1103/PhysRev.93.1428.
- ^ Choppin, G. R.; Thompson, S. G.; Ghiorso, A.; Harvey, B. G. Nuclear Properties of Some Isotopes of Californium, Elements 99 and 100. Physical Review. 1954, 94 (4): 1080–1081. Bibcode:1954PhRv...94.1080C. doi:10.1103/PhysRev.94.1080.
- ^ Fields, P.; Studier, M.; Mech, J.; Diamond, H.; Friedman, A.; Magnusson, L.; Huizenga, J. Additional Properties of Isotopes of Elements 99 and 100. Physical Review. 1954, 94: 209. Bibcode:1954PhRv...94..209F. doi:10.1103/PhysRev.94.209.
- ^ G. T. Seaborg, S.G. Thompson, B.G. Harvey, G.R. Choppin, "Chemical Properties of Elements 99 and 100" (页面存档备份,存于互联网档案馆) (July 23, 1954), Radiation Laboratory, University of California, Berkeley, UCRL-2591
- ^ Thompson, S. G.; Harvey, B. G.; Choppin, G. R.; Seaborg, G. T. Journal of the American Chemical Society. 1954, 76 (24): 6229. doi:10.1021/ja01653a004. 缺少或
|title=为空 (帮助) - ^ Atterling, Hugo; Forsling, Wilhelm; Holm, Lennart; Melander, Lars; Åström, Björn. Element 100 Produced by Means of Cyclotron-Accelerated Oxygen Ions. Physical Review. 1954, 95 (2): 585. Bibcode:1954PhRv...95..585A. doi:10.1103/PhysRev.95.585.2.
- ^ Haire, p. 1577
- ^ Seaborg, G.T. (1994) Modern alchemy: selected papers of Glenn T. Seaborg (页面存档备份,存于互联网档案馆), World Scientific, ISBN 978-981-02-1440-1, p. 6
- ^ Haire, p. 1580
- ^ R. G. Haire: "Properties of the Transplutonium Metals (Am-Fm)", in: Metals Handbook, Vol. 2, 10th edition, (ASM International, Materials Park, Ohio, 1990), pp. 1198–1201.
- ^ Haire, p. 1591
- ^ 26.0 26.1 Haire, R. Preparation, properties, and some recent studies of the actinide metals. Journal of the Less Common Metals. 1986, 121: 379 [2013-02-24]. doi:10.1016/0022-5088(86)90554-0. (原始内容存档于2013-05-13).
- ^ 27.0 27.1 Greenwood, p. 1268
- ^ 28.0 28.1 Haire, p. 1579
- ^ 29.0 29.1 Haire, R. G.; Baybarz, R. D. Studies of einsteinium metal (PDF). Le Journal de Physique. 1979, 40: C4–101 [2013-02-24]. doi:10.1051/jphyscol:1979431. (原始内容 (PDF)存档于2012-03-07). draft manuscript (页面存档备份,存于互联网档案馆)
- ^ Seaborg, p. 61
- ^ Kleinschmidt, Phillip D.; Ward, John W.; Matlack, George M.; Haire, Richard G. Henry’s Law vaporization studies and thermodynamics of einsteinium-253 metal dissolved in ytterbium. The Journal of Chemical Physics. 1984, 81: 473. Bibcode:1984JChPh..81..473K. doi:10.1063/1.447328.
- ^ Seaborg, p. 52
- ^ 33.0 33.1 Seaborg, p. 60
- ^ 34.0 34.1 34.2 Ensor, D.D.; Peterson, J.R.; Haire, R.G.; Young, J.P. Absorption spectrophotometric study of 253EsF3 and its decay products in the bulk-phase solid state. Journal of Inorganic and Nuclear Chemistry. 1981, 43 (10): 2425. doi:10.1016/0022-1902(81)80274-6.
- ^ 35.0 35.1 35.2 Haire, R.G.; Baybarz, R.D. Identification and analysis of einsteinium sesquioxide by electron diffraction. Journal of Inorganic and Nuclear Chemistry. 1973, 35 (2): 489. doi:10.1016/0022-1902(73)80561-5.
- ^ Seaborg, p. 55
- ^ Seaborg, p. 76
- ^ Huray, P; Nave, S; Haire, R. Magnetism of the heavy 5f elements. Journal of the Less Common Metals. 1983, 93 (2): 293. doi:10.1016/0022-5088(83)90175-3.
- ^ Huray, Paul G.; Nave, S.E.; Haire, R.G.; Moore, J.R. Magnetic Properties of Es2O3 and EsF3. Inorganica Chimica Acta. 1984, 94: 120. doi:10.1016/S0020-1693(00)94587-0.
- ^ Holeman, p. 1956
- ^ Seaborg, p. 53
- ^ Haire, p. 1578
- ^ 43.0 43.1 Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. The NUBASE2020 evaluation of nuclear properties (PDF). Chinese Physics C. 2021, 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ Ahmad, I. Half-life of the longest-lived einsteinium isotope-252Es. Journal of Inorganic and Nuclear Chemistry. 1977, 39 (9): 1509. doi:10.1016/0022-1902(77)80089-4.
- ^ McHarris, William; Stephens, F.; Asaro, F.; Perlman, I. Decay Scheme of Einsteinium-254. Physical Review. 1966, 144 (3): 1031. Bibcode:1966PhRv..144.1031M. doi:10.1103/PhysRev.144.1031.
- ^ Institut de Radioprotection et de Sûreté Nucléaire, "Evaluation of nuclear criticality safety data and limits for actinides in transport" (页面存档备份,存于互联网档案馆), p. 16.
- ^ Emsley, John. Nature's Building Blocks: An A-Z Guide to the Elements New. New York, NY: Oxford University Press. 2011. ISBN 978-0-19-960563-7.
- ^ Seaborg, p. 51
- ^ High Flux Isotope Reactor. Oak Ridge National Laboratory. [2010-09-23]. (原始内容存档于2015-02-28).
- ^ Радионуклидные источники и препараты. Research Institute of Atomic Reactors. [2010-09-26]. (原始内容存档于2020-07-26) (俄语).
- ^ 51.0 51.1 Haire, p. 1582
- ^ Greenwood, p. 1262
- ^ Porter, C. E.; Riley, F. D., Jr.; Vandergrift, R. D.; Felker, L. K. Fermium Purification Using Teva Resin Extraction Chromatography. Sep. Sci. Technol. 1997, 32 (1–4): 83–92. doi:10.1080/01496399708003188.
- ^ Darleane C. Hoffman, Albert Ghiorso, Glenn Theodore Seaborg: The Transuranium People: The Inside Story, Imperial College Press, 2000, ISBN 978-1-86094-087-3, pp. 190–191.
- ^ Seaborg, pp. 36–37
- ^ Jones, M.; Schuman, R.; Butler, J.; Cowper, G.; Eastwood, T.; Jackson, H. Isotopes of Einsteinium and Fermium Produced by Neutron Irradiation of Plutonium. Physical Review. 1956, 102: 203. Bibcode:1956PhRv..102..203J. doi:10.1103/PhysRev.102.203.
- ^ Guseva, L; Filippova, K; Gerlit, Y; Druin, V; Myasoedov, B; Tarantin, N. Experiments on the production of einsteinium and fermium with a cyclotron. Journal of Nuclear Energy (1954). 1956, 3 (4): 341. doi:10.1016/0891-3919(56)90064-X.
- ^ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 978-3-7776-0736-8, pp. 18–23.
- ^ Эйнштейний (页面存档备份,存于互联网档案馆)(俄文,由其中一位参与的科学家著)
- ^ Chetham-Strode, A.; Holm, L. New Isotope Einsteinium-248. Physical Review. 1956, 104 (5): 1314. Bibcode:1956PhRv..104.1314C. doi:10.1103/PhysRev.104.1314.
- ^ Harvey, Bernard; Chetham-Strode, Alfred; Ghiorso, Albert; Choppin, Gregory; Thompson, Stanley. New Isotopes of Einsteinium. Physical Review. 1956, 104 (5): 1315. Bibcode:1956PhRv..104.1315H. doi:10.1103/PhysRev.104.1315.
- ^ Kulyukhin, S. Production of microgram quantities of einsteinium-253 by the reactor irradiation of californium. Inorganica Chimica Acta. 1985, 110: 25. doi:10.1016/S0020-1693(00)81347-X.
- ^ 63.0 63.1 63.2 Seaborg, p. 40
- ^ United States Nuclear Tests July 1945 through September 1992 互联网档案馆的存档,存档日期2006-10-12., DOE/NV--209-REV 15, December 2000
- ^ Seaborg, p. 43
- ^ Seaborg, p. 44
- ^ Seaborg, p. 47
- ^ Haire, p. 1583
- ^ Haire, pp. 1584–1585
- ^ 70.0 70.1 Hall, Nina. The new chemistry. Cambridge University Press. 2000: 9–11 [2013-02-24]. ISBN 0-521-45224-4. (原始内容存档于2020-11-14).
- ^ Haire, p. 1588
- ^ Sicius, Hermann. Radioaktive Elemente: Actinoide: Eine Reise durch das Periodensystem. Springer-Verlag. 2015-07-01: 55 [2016-12-24]. ISBN 9783658098292. (原始内容存档于2021-05-19) (德语).
- ^ Haire, p. 1590
- ^ 74.0 74.1 74.2 Haire, R. G. and Eyring, L. Lanthanides and Actinides Chemistry. K.A. Gscheidner, Jr. et al. (编). Handbook on the Physics and Chemistry of Rare Earths 18. North-Holland, New York. 1994: 414–505. ISBN 0-444-81724-7.
- ^ Kleinschmidt, P. Thermochemistry of the actinides. Journal of Alloys and Compounds. 1994,. 213–214: 169. doi:10.1016/0925-8388(94)90898-2.
- ^ Fujita, D. Crystal structures and lattice parameters of einsteinium trichloride and einsteinium oxychloride. Inorganic and Nuclear Chemistry Letters. 1969, 5 (4): 307. doi:10.1016/0020-1650(69)80203-5.
- ^ 77.0 77.1 Miasoedov, B. F. Analytical chemistry of transplutonium elements, Wiley, 1974 (Original from the University of California), ISBN 978-0-470-62715-0, p. 99
- ^ Fellows, R. X-ray diffraction and spectroscopic studies of crystalline einsteinium(III) bromide, 253EsBr3. Inorganic and Nuclear Chemistry Letters. 1975, 11 (11): 737. doi:10.1016/0020-1650(75)80090-0.
- ^ 79.0 79.1 79.2 Haire, pp. 1595–1596
- ^ 80.0 80.1 80.2 Seaborg, p. 62
- ^ 81.0 81.1 81.2 81.3 81.4 Young, J. P.; Haire, R. G.; Peterson, J. R.; Ensor, D. D.; Fellow, R. L. Chemical consequences of radioactive decay. 2. Spectrophotometric study of the ingrowth of berkelium-249 and californium-249 into halides of einsteinium-253. Inorganic Chemistry. 1981, 20 (11): 3979. doi:10.1021/ic50225a076.
- ^ Haire, p. 1598
- ^ Holleman, p. 1969
- ^ 84.0 84.1 84.2 Greenwood, p. 1270
- ^ Young, J. P.; Haire, R. G.; Fellows, R. L.; Peterson, J. R. Spectrophotometric studies of transcurium element halides and oxyhalides in the solid state. Journal of Radioanalytical Chemistry. 1978, 43 (2): 479. doi:10.1007/BF02519508.
- ^ Fujita, D. The solution absorption spectrum of Es3+. Inorganic and Nuclear Chemistry Letters. 1969, 5 (4): 245. doi:10.1016/0020-1650(69)80192-3.
- ^ 87.0 87.1 Peterson, J.R.; et al. Preparation, characterization, and decay of einsteinium(II) in the solid state (PDF). Le Journal de Physique. 1979, 40 (4): C4–111 [2013-02-24]. (原始内容 (PDF)存档于2012-03-07). manuscript draft (页面存档备份,存于互联网档案馆)
- ^ Fellows, R.L.; Young, J.P.; Haire, R.G. and Peterson J.R., in: The Rare Earths in Modern Science and Technology(edited by GJ McCarthy and JJ Rhyne), Plenum Press, New York 1977, pp. 493–499.
- ^ Young, J.P.; Haire R.G., Fellows, R.L.; Noe, M. and Peterson, J.R. "Spectroscopic and X-ray Diffraction Studies of the bromide of Cf-249 and E-253", in: Plutonium 1975 (ed. W. Müller and R. Lindner), North Holland, Amsterdam 1976, pp. 227–234.
- ^ Nugent, Leonard J.; Burnett, J. L.; Baybarz, R. D.; Werner, George Knoll; Tanner, S. P.; Tarrant, J. R.; Keller, O. L. Intramolecular energy transfer and sensitized luminescence in actinide(III) .beta.-diketone chelates. The Journal of Physical Chemistry. 1969, 73 (5): 1540. doi:10.1021/j100725a060.
- ^ Beitz, J; Wester, D; Williams, C. 5f state interaction with inner coordination sphere ligands: Es3+ ion fluorescence in aqueous and organic phases. Journal of the Less Common Metals. 1983, 93 (2): 331. doi:10.1016/0022-5088(83)90178-9.
- ^ It's Elemental – The Element Einsteinium (页面存档备份,存于互联网档案馆). Retrieved 2 December 2007.
- ^ Ghiorso, A.; Harvey, B.; Choppin, G.; Thompson, S.; Seaborg, G. New Element Mendelevium, Atomic Number 101. Physical Review. 1955, 98 (5): 1518 [2013-02-24]. Bibcode:1955PhRv...98.1518G. ISBN 978-981-02-1440-1. doi:10.1103/PhysRev.98.1518. (原始内容存档于2021-04-27).
- ^ Schadel, M; Bruchle, W; Brugger, M; Gaggeler, H; Moody, K; Schardt, D; Summerer, K; Hulet, E; Dougan, A. Heavy isotope production by multinucleon transfer reactions with 254Es. Journal of the Less Common Metals. 1986, 122: 411. doi:10.1016/0022-5088(86)90435-2.
- ^ Lougheed, R. W.; Landrum, J. H.; Hulet, E. K.; Wild, J. F.; Dougan, R. J.; Dougan, A. D.; Gäggeler, H.; Schädel, M.; Moody, K. J.; Gregorich, K. E. and Seaborg, G. T. Search for superheavy elements using 48Ca + 254Esg reaction. Physical Reviews C. 1985, 32 (5): 1760–1763. Bibcode:1985PhRvC..32.1760L. doi:10.1103/PhysRevC.32.1760.
- ^ Turkevich, A. L.; Franzgrote, E. J.; Patterson, J. H. Chemical Analysis of the Moon at the Surveyor V Landing Site. Science. 1967, 158 (3801): 635–637. Bibcode:1967Sci...158..635T. PMID 17732956. doi:10.1126/science.158.3801.635.
- ^ International Commission on Radiological Protection. Limits for intakes of radionuclides by workers, Part 4, Volume 19, Issue 4. Elsevier Health Sciences. 1988: 18–19 [2013-02-24]. ISBN 0-08-036886-7. (原始内容存档于2016-04-25).
书目
[编辑]- Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).
- Haire, Richard G. Einsteinium. Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean (编). The Chemistry of the Actinide and Transactinide Elements (PDF) 3 3rd. Dordrecht, the Netherlands: Springer. 2006: 1577–1620. doi:10.1007/1-4020-3598-5_12. (原始内容 (PDF)存档于2010-07-17).
- Holleman, Arnold F. and Wiberg, Nils Textbook of Inorganic Chemistry, 102 Edition, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Seaborg, G.T. (ed.) (1978) Proceedings of the Symposium Commemorating the 25th Anniversary of Elements 99 and 100 (页面存档备份,存于互联网档案馆), 23 January 1978, Report LBL-7701
外部链接
[编辑]- 元素锿在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 锿(英文)
- 元素锿在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素锿在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 锿(英文)
- Age-related factors in radionuclide metabolism and dosimetry: Proceedings – contains several health related studies of einsteinium




![{\displaystyle \mathrm {^{238}_{\ 92}U\ {\xrightarrow[{-2\ \beta ^{-}}]{+\ 6\ (n,\gamma )}}\ _{\ 94}^{244}Pu} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c4b60ac4bf0d4ebf96b6a71fefa86f13dd5784e0)
![{\displaystyle \mathrm {^{238}_{\ 92}U\ {\xrightarrow[{6\beta ^{-}}]{+\ 15n}}\ _{\ 98}^{253}Cf\ {\xrightarrow {\beta ^{-}}}\ _{\ 99}^{253}Es} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a31a30299275cd5befba08f435caf06cd5f94dc1)
![{\displaystyle \mathrm {^{252}_{\ 98}Cf\ {\xrightarrow {(n,\gamma )}}\ _{\ 98}^{253}Cf\ {\xrightarrow[{17.81\ d}]{\beta ^{-}}}\ _{\ 99}^{253}Es\ {\xrightarrow {(n,\gamma )}}\ _{\ 99}^{254}Es\ {\xrightarrow[{}]{\beta ^{-}}}\ _{100}^{254}Fm} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9999031c3fb72d9bc5d4d8ac1094a6b950c2917a)
![{\displaystyle \mathrm {^{253}_{\ 99}Es\ {\xrightarrow[{20\ d}]{\alpha }}\ _{\ 97}^{249}Bk\ {\xrightarrow[{314\ d}]{\beta ^{-}}}\ _{\ 98}^{249}Cf} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a2e6d53c027c0247a7ddbc0c45718d09789f2da2)
![{\displaystyle \mathrm {^{249}_{\ 98}Cf\ +\ _{1}^{2}D\ \longrightarrow \ _{\ 99}^{248}Es\ +\ 3\ _{0}^{1}n\quad (_{\ 99}^{248}Es\ {\xrightarrow[{27\ min}]{\beta +}}\ _{\ 98}^{248}Cf)} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d0cffa962336cce6671d2fb38652eef8ddb40e2)

![{\displaystyle \mathrm {^{252}_{\ 98}Cf\ {\xrightarrow {(n,\gamma )}}\ _{\ 98}^{253}Cf\ {\xrightarrow[{17.81\ d}]{\beta ^{-}}}\ _{\ 99}^{253}Es} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/77116baa20d9264038d2b62a28ab3193df111497)
