氰化氫
| 氫氰酸 | |
|---|---|

| |

| |
| IUPAC名 | |
| 別名 | 氫氰酸,甲腈 |
| 識別 | |
| CAS編號 | 74-90-8 |
| PubChem | 768 |
| ChemSpider | 748 |
| SMILES |
|
| 3DMet | B00275 |
| UN編號 | 1051 |
| EINECS | 200-821-6 |
| ChEBI | 18407 |
| RTECS | MW6825000 |
| KEGG | C01326 |
| MeSH | Hydrogen+Cyanide |
| 性質 | |
| 化學式 | HCN |
| 摩爾質量 | 27.03 g·mol⁻¹ |
| 外觀 | 無色氣體或淡藍色[3]易揮發液體 |
| 密度 | 0.6876 g cm−3[4] |
| 熔點 | -13.29 °C(260 K)([4]) |
| 沸點 | 26 °C(299 K)([4]) |
| 溶解性(水) | 易溶 |
| 蒸氣壓 | 100 kPa (25 °C)[5] |
| pKa | 9.21(水中) 12.9(DMSO中)[6] |
| 折光度n D |
1.2675 [7] |
| 黏度 | 0.183 mPa·s (25 °C)[8] |
| 結構 | |
| 分子構型 | 直線形 |
| 偶極矩 | 2.98 D |
| 熱力學 | |
| ΔfHm⦵298K | 135.1 kJ mol−1 |
| S⦵298K | 201.8 J K−1 mol−1 |
| 熱容 | 35.9 J K−1 mol−1 (氣體)[9] |
| 危險性 | |
| 警示術語 | R:R12-R26-R27-R28-R32 |
| 安全術語 | S:S1/2-S7-S9-S13-S16-S28-S29-S45 |
| 主要危害 | 劇毒及易燃 |
| NFPA 704 | |
| 閃點 | −17.78 °C |
| 爆炸極限 | 5.6% – 40.0%[10] |
| PEL | TWA 10 ppm (11 mg/m3) [skin][10] |
| 致死量或濃度: | |
LC50(中位濃度)
|
501 ppm (大鼠, 5 min) 323 ppm (小鼠, 5 min) 275 ppm (大鼠, 15 min) 170 ppm (大鼠, 30 min) 160 ppm (大鼠, 30 min) 323 ppm (大鼠, 5 min)[11] |
LCLo(最低)
|
200 ppm (哺乳動物, 5 min) 36 ppm (哺乳動物, 2 hr) 107 ppm (人類, 10 min) 759 ppm (兔子, 1 min) 759 ppm (貓, 1 min) 357 ppm (人類, 2 min) 179 ppm (人類, 1 hr)[11] |
| 相關物質 | |
| 相關化學品 | 氰、氯化氰、磷雜乙炔 三甲基氰矽烷 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
氰化氫,又稱氫氰酸,化學式HCN,相當擬鹵素氰的擬鹵化氫。標準狀態下為液體,劇毒且致命,無色而苦,並有淡淡的杏仁氣味(杏桃的果核中含有苦杏仁苷,溶於水會釋放出氰化氫[12]),能否嗅出視乎個人基因[13]。氰化氫是一種弱酸,沸點26℃(79°F)。氰化氫是一個線性分子,碳和氮之間具有三鍵。
歷史
[編輯]
氫氰酸首次在一種1706年已知的藍色染料(普魯士藍)中提取,不過普魯士藍的結構在當時仍然未知。它現在的結構是已知的,為水合鐵氰化鐵的配位聚合物。1752年,法國化學家 Pierre Macquer 展示出普魯士藍可以分解成一種氧化鐵和一種揮發性物質,後兩者還可以重新反應生成普魯士藍。[14]這種新的揮發性物質就是現在的氫氰酸。根據 Macquer的領導,卡爾·威廉·舍勒於 1782成功從普魯士藍中分離出氫氰酸,[15] 並命名為Blausäure (德文,意為藍酸),因為它的水溶液是酸性的,並且來自於普魯士藍。
1787年,法國化學家克勞德·貝托萊展示出了氫氰酸不含氧,[16]是研究酸理論中重大貢獻之一,推翻了酸必要有氧原子的理論[17]。1811年,約瑟夫·路易·給呂薩克製備了純的液態氰化氫。[18]1815年,他也說明了氫氰酸的化學式。[19]氫氰酸的共軛鹼,氰離子(英語:cyanide)的名稱由cyan衍生而來。
製取
[編輯]最重要的工業製取氰化氫的方法要數Andrussow氧化反應,它是通過甲烷、氨氣以及氧氣在約1200°C經由鉑催化得到氰化氫:
- 其中反應所需能量由甲烷和氨氣的部分氧化提供。
或者由石墨與氨氣加強熱生成氣體,冷凝後得液體氰化氫。
也可以用甲酸銨進行脫水(可以用五氧化二磷)來製取,這是一種比較快捷,原料易得的方法,適合在暫時無氰化物的時候製取少量氰化氫。
應用
[編輯]HCN 是氰化鈉和氰化鉀的前體,後兩者可用於開採金和銀,來獲得這些金屬。經過氰醇中間體,一系列由 HCN 製成的有用有機化合物包括甲基丙烯酸甲酯單體、經過斯特雷克氨基酸合成反應製成的甲硫氨酸、嵌合劑EDTA和NTA。 經過氫氰化反應,HCN 可以加合到丁二烯,形成己二腈,一種合成尼龍-6,6的前體。[21]
化學性質
[編輯]分子可溶於水中形成氫氰酸。可與鹵代烴進行親核取代反應(SN),及與羰基化合物進行親核加成反應生成α-羥基腈。由於可以使化合物增加一個碳原子,故是重要的有機合成試劑和化工步驟,實際上常用CN−作親核試劑。
存在
[編輯]HCN 可以從一些水果里獲得,像是櫻桃、杏組、蘋果和苦杏仁,杏仁油和調味品就是從中提取的。 它們有少量的羥腈,像是扁桃腈和扁桃苷,會緩慢釋放氫氰酸。[22][23] 100克的碎蘋果種子可以得到 70 mg 的 HCN。[24] 一些千足蟲也會釋放氫氰酸來防禦,[25] 一些昆蟲也是如此,例如斑蛾科。氫氰酸是交通工具產生的一種廢氣,也可以由含氮塑膠燃燒而成。木薯根甚至有每公斤 1 克的 HCN。[26][27]
土衛六的HCN
[編輯]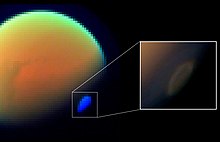
卡西尼-惠更斯號太空探測器上的四台儀器、旅行者1號上的一台儀器和地球上的一台儀器在土衛六大氣中測量到了氫氰酸。[28] 還有一個是原位測量,其中卡西尼號在土衛六表面上方 1,000至1,100 km(620至680 mi) 處收集大氣氣體進行質譜分析。 [29] HCN最初是通過光化學產生的甲烷和氮自由基的反應經過 H2CN 自由基在土衛六的大氣中形成的:[30][31]
CH3 + N → H2CN + H → HCN + H2
紫外線會把 HCN 分解成 CN + H。不過, CN 會通過 CN + CH4 → HCN + CH3反應重新變成氫氰酸。[30]
早期地球的HCN
[編輯]據推測,木星和土星相互作用產生的一系列小行星(稱為後期重轟炸期)的碳炸毀了年輕地球的表面,並與地球大氣中的氮氣反應, 形成氫氰酸。[32]
哺乳動物里的 HCN
[編輯]一些作者表示腦神經可以在阿片類藥物受體通過內源性或外源性阿片類藥物的激發下產生氫氰酸。他們還表明,HCN的神經元產生會激活N-甲基-D-天門冬氨酸受體,並在神經元細胞之間的信號轉導中發揮作用。 此外,由於大量的阿片類藥物的鎮痛作用被HCN清除劑減弱,因此在阿片類藥物的鎮壓下似乎需要增加內源性神經元HCN的產生。他們認為內源性HCN是神經調節劑。 [33]
還已經表明,儘管在培養的嗜膽鹼細胞中刺激蕈毒鹼型乙酰膽鹼受體,增加了HCN的產生,但是在活生物體中,蕈毒鹼型乙酰膽鹼受體的刺激實際上降低了HCN的產生。 [34]
白血球在吞噬作用中產生HCN,並可以通過產生幾種不同的有毒化學物質殺死細菌,真菌和其他病原體,其中一種是氫氰酸。 [33]
已顯示,由硝普鈉引起的血管舒張不僅通過NO的產生來介導,而且還通過內源性氰化物的產生來介導,與硝酸甘油和其他非氰類的硝酸鹽相比,不僅增加了毒性,而且還增加了血液中的氰化物濃度。 [35]
HCN 和生命起源
[編輯]氫氰酸作為核酸和氨基酸的前體被討論,也可能是生命起源的一部分。[37] 儘管這些化學反應與生命理論起源的關係仍然是推測性的,但該領域的研究已經發現了從HCN的聚合中獲得有機化合物的新途徑,例如腺嘌呤可以由氫氰酸五聚而成。 [38]
危害
[編輯]健康危害:抑制細胞色素氧化酶,造成細胞內窒息。可致眼、皮膚灼傷,吸收引起中毒。
急性中毒:
- 短時間內吸入高濃度氰化氫氣體,可立即呼吸停止而死亡。
- 非驟死者臨床分為4期:
- 前驅期有粘膜刺激、呼吸加快加深、乏力、頭痛;口服有舌尖、口腔發麻等。
- 呼吸困難期有呼吸困難、血壓升高、皮膚粘膜呈鮮紅色等。
- 驚厥期出現抽搐、昏迷、呼吸衰竭。
- 麻痹期全身肌肉鬆弛,呼吸心跳停止而死亡。
作為一種毒素和化學武器
[編輯]在第一次世界大戰中,法國從1916年開始使用氫氰酸作為化學武器對付同盟國,美國和意大利在1918年也將氫氰酸用作對付同盟國的化學武器,但由於密度的原因,氫氰酸並不有效。[39][40] 氰化氫氣體比空氣輕,會直接飄散,這和比空氣重的光氣和氯氣形成對比,它們會停留在地面,沉入 塹壕。這可以使它們的濃度增加,直至致死濃度。這些缺點使得氰化氫根本不能用於戰場。當氫氰酸在空氣的濃度為 100–200 ppm 時,可以在 10 到 60 分鐘殺死人。[41] 當氫氰酸的濃度達到 2000 ppm (大概 2380 mg/m3) ,它可以在一分鐘殺死人。[41] 這是由於氰根離子造成的,它通過作為線粒體中的細胞色素c氧化酶的非競爭性抑制劑來阻止細胞呼吸。因此,氫氰酸被歸類為化學武器的血液抑制劑。[42] 它屬於禁止化學武器公約的第三類物質,它有合法的大規模民用,年產30噸氫氰酸以上的工廠必須登記,且允許檢查。
氫氰酸可用作殺蟲劑。 其中最著名的是Zyklon B (德文: Cyclone B,其中B 代表 Blausäure – 普魯士酸,也可以用來消除和後來稱為的 Zyklon A 的東西的歧義)。[43] 在第二次世界大戰期間,納粹德國滅絕營使用了它來殺死群眾,作為其最終解決方案種族滅絕計劃的一部分。 難民營中也使用氫氰酸消滅衣服,企圖消滅虱子和其他寄生蟲攜帶的疾病。 最初的捷克生產商之一繼續以商標 Uragan D2 生產Zyklon B[44],直到今天。氫氰酸還是美國某些州執行死刑中使用的試劑,在執行過程中,氫氰酸是通過硫酸和氰化鈉或氰化鉀反應而產生的。
從18世紀中葉開始,它被用於一些謀殺和自殺。 [45]
氰化氫氣體在 5.6%的濃度以上時會爆炸。[46] 這個值遠高於致死量。
參閱
[編輯]參考資料
[編輯]- ^ Hydrogen Cyanide – Compound Summary. PubChem Compound. United States: National Center for Biotechnology Information. Identification. 16 September 2004 [2012-06-04]. (原始內容存檔於2014-01-16).
- ^ hydrogen cyanide (CHEBI:18407). Chemical Entities of Biological Interest. UK: European Bioinformatics Institute. Main. 18 October 2009 [2012-06-04]. (原始內容存檔於2021-04-04).
- ^ Hydrogen cyanide. PubChem Database. National Center for Biotechnology Information. [2019-11-08]. (原始內容存檔於2019-11-08).
... Hydrogen cyanide, anhydrous, stabilized appears as very volatile colorless or pale-blue liquid or gas ...
- ^ 4.0 4.1 4.2 Haynes, 4.67
- ^ Haynes, 6.94
- ^ Evans, D. A. pKa's of Inorganic and Oxo-Acids (PDF). [June 19, 2020]. (原始內容存檔 (PDF)於2021-03-16).
- ^ Patnaik, P. Handbook of Inorganic Chemicals. McGraw-Hill. 2002. ISBN 978-0-07-049439-8.
- ^ Haynes, 6.231
- ^ Haynes, 5.19
- ^ 10.0 10.1 NIOSH Pocket Guide to Chemical Hazards. #0333. NIOSH.
- ^ 11.0 11.1 Hydrogen cyanide. Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ 車振明,李明元. 高等学校专业教材 食品安全学. 2013. ISBN 7501992576.
- ^ 天津爆炸的危险品可能是什么?. [2015-08-18]. (原始內容存檔於2016-01-26).
- ^ Macquer, Pierre-Joseph (presented: 1752; published: 1756) "Éxamen chymique de bleu de Prusse" (頁面存檔備份,存於互聯網檔案館) (Chemical examination of Prussian blue), Mémoires de l'Académie royale des Sciences , pp. 60–77.
- ^ Scheele, Carl W. (1782) "Försök, beträffande det färgande ämnet uti Berlinerblå" (頁面存檔備份,存於互聯網檔案館) (Experiment concerning the coloring substance in Berlin blue), Kungliga Svenska Vetenskapsakademiens handlingar (Royal Swedish Academy of Science's Proceedings), 3: 264–275 (in Swedish).
Reprinted in Latin as: "De materia tingente caerulei berolinensis" (頁面存檔備份,存於互聯網檔案館) in: Carl Wilhelm Scheele with Ernst Benjamin Gottlieb Hebenstreit (ed.) and Gottfried Heinrich Schäfer (trans.), Opuscula Chemica et Physica (Leipzig ("Lipsiae"), (Germany): Johann Godfried Müller, 1789), vol. 2, pages 148–174. - ^ Berthollet, C. L. (presented: 1787 ; published: 1789)
"Mémoire sur l'acide prussique" (頁面存檔備份,存於互聯網檔案館) (Memoir on prussic acid), Mémoires de l'Académie Royale des Sciences, pages 148–161.
Reprinted in: Berthollet, C. L. Extrait d'un mémoire sur l'acide prussique [Extract of a memoir on prussic acid]. Annales de Chimie. 1789, 1: 30–39 [2021-02-13]. (原始內容存檔於2021-11-17). - ^ Newbold, B. T. Claude Louis Berthollet: A Great Chemist in the French Tradition. Canadian Chemical News. 1999-11-01 [2010-03-31]. (原始內容存檔於2008-04-20).
- ^ Gay-Lussac, J. L. Note sur l'acide prussique [Note on prussic acid]. Annales de Chimie. 1811, 44: 128–133 [2021-02-13]. (原始內容存檔於2021-03-15).
- ^ Gay-Lussac, J. L. Recherche sur l'acide prussique [Research on prussic acid]. Annales de Chimie. 1815, 95: 136–231 [2021-02-13]. (原始內容存檔於2021-03-15).
- ^ Andrussow, L. Über die katalytische Oxydation von Ammoniak-Methan-Gemischen zu Blausäure. Angewandte Chemie. 1935-09-14, 48 (37): 593–595. doi:10.1002/ange.19350483702 (德語).
- ^ Gail, E.; Gos, S.; Kulzer, R.; Lorösch, J.; Rubo, A.; Sauer, M., Cyano Compounds, Inorganic, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a08_159.pub2
- ^ Vetter, J. Plant cyanogenic glycosides. Toxicon. 2000, 38 (1): 11–36. PMID 10669009. doi:10.1016/S0041-0101(99)00128-2.
- ^ Jones, D. A. Why are so many food plants cyanogenic?. Phytochemistry. 1998, 47 (2): 155–162. PMID 9431670. doi:10.1016/S0031-9422(97)00425-1.
- ^ Are Apple Cores Poisonous?. The Naked Scientists. 26 September 2010 [6 March 2014]. (原始內容存檔於2014-03-06).
- ^ Blum, M. S.; Woodring, J. P. Secretion of Benzaldehyde and Hydrogen Cyanide by the Millipede Pachydesmus crassicutis (Wood). Science. 1962, 138 (3539): 512–513. Bibcode:1962Sci...138..512B. PMID 17753947. S2CID 40193390. doi:10.1126/science.138.3539.512.
- ^ Aregheore, E. M.; Agunbiade, O. O. The toxic effects of cassava (Manihot esculenta Crantz) diets on humans: a review. Veterinary and Human Toxicology. 1991, 33 (3): 274–275. PMID 1650055.
- ^ White, W. L. B.; Arias-Garzon, D. I.; McMahon, J. M.; Sayre, R. T. Cyanogenesis in Cassava, The Role of Hydroxynitrile Lyase in Root Cyanide Production. Plant Physiology. 1998, 116 (4): 1219–1225. PMC 35028
 . PMID 9536038. doi:10.1104/pp.116.4.1219.
. PMID 9536038. doi:10.1104/pp.116.4.1219.
- ^ Loison, J.C.; Hébrard, E.; Dobrijevic, M.; Hickson, K.M.; Caralp, F.; Hue, V.; Gronoff, G.; Venot, O.; Bénilan, Y. The neutral photochemistry of nitriles, amines and imines in the atmosphere of Titan. Icarus. February 2015, 247: 218–247. Bibcode:2015Icar..247..218L. doi:10.1016/j.icarus.2014.09.039.
- ^ Magee, Brian A.; Waite, J. Hunter; Mandt, Kathleen E.; Westlake, Joseph; Bell, Jared; Gell, David A. INMS-derived composition of Titan's upper atmosphere: Analysis methods and model comparison. Planetary and Space Science. December 2009, 57 (14–15): 1895–1916. Bibcode:2009P&SS...57.1895M. doi:10.1016/j.pss.2009.06.016.
- ^ 30.0 30.1 Pearce, Ben K. D.; Molaverdikhani, Karan; Pudritz, Ralph; Henning, Thomas; Hébrard, Erid. HCN Production in Titan's Atmosphere: Coupling Quantum Chemistry and Disequilibrium Atmospheric Modeling. Astrophysical Journal. 2020, 901 (2): 110. S2CID 221095540. arXiv:2008.04312
 . doi:10.3847/1538-4357/abae5c.
. doi:10.3847/1538-4357/abae5c.
- ^ Pearce, Ben K. D.; Ayers, Paul W.; Pudritz, Ralph E. A Consistent Reduced Network for HCN Chemistry in Early Earth and Titan Atmospheres: Quantum Calculations of Reaction Rate Coefficients. The Journal of Physical Chemistry A. 2019-02-20, 123 (9): 1861–1873. Bibcode:2019JPCA..123.1861P. ISSN 1089-5639. PMID 30721064. S2CID 73442008. arXiv:1902.05574
 . doi:10.1021/acs.jpca.8b11323.
. doi:10.1021/acs.jpca.8b11323.
- ^ Wade, Nicholas. Making Sense of the Chemistry That Led to Life on Earth. The New York Times. 2015-05-04 [5 May 2015]. (原始內容存檔於2017-07-09).
- ^ 33.0 33.1 Borowitz JL, Gunasekar PG, Isom GE. Hydrogen cyanide generation by mu-opiate receptor activation: possible neuromodulatory role of endogenous cyanide. Brain Res. 12 Sep 1997, 768 (1–2): 294–300. PMID 9369328. S2CID 12277593. doi:10.1016/S0006-8993(97)00659-8.
- ^ Gunasekar PG, Prabhakaran K, Li L, Zhang L, Isom GE, Borowitz JL. Receptor mechanisms mediating cyanide generation in PC12 cells and rat brain. Neurosci Res. May 2004, 49 (1): 13–18. PMID 15099699. S2CID 29850349. doi:10.1016/j.neures.2004.01.006.
- ^ Smith RP, Kruszyna H. Toxicology of some inorganic antihypertensive anions.. Fed Proc. Jan 1976, 35 (1): 69–72. PMID 1245233.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon. Hazardous Compounds in Tobacco Smoke. International Journal of Environmental Research and Public Health. 2011, 8 (12): 613–628. ISSN 1660-4601. PMC 3084482
 . PMID 21556207. doi:10.3390/ijerph8020613.
. PMID 21556207. doi:10.3390/ijerph8020613.
- ^ Matthews, C. N. The HCN World: Establishing Protein – Nucleic Acid Life via Hydrogen Cyanide Polymers. Origins: Genesis, Evolution and Diversity of Life. Cellular Origin and Life in Extreme Habitats and Astrobiology 6. 2004: 121–135. ISBN 978-1-4020-2522-8. doi:10.1007/1-4020-2522-X_8.
- ^ Al-Azmi, A.; Elassar, A.-Z. A.; Booth, B. L. The Chemistry of Diaminomaleonitrile and its Utility in Heterocyclic Synthesis. Tetrahedron. 2003, 59 (16): 2749–2763. doi:10.1016/S0040-4020(03)00153-4.
- ^ Schnedlitz, Markus (2008) Chemische Kampfstoffe: Geschichte, Eigenschaften, Wirkung. GRIN Verlag. p. 13. ISBN 364023360-3.
- ^ Weapons of War - Poison Gas (頁面存檔備份,存於互聯網檔案館). firstworldwar.com
- ^ 41.0 41.1 Environmental and Health Effects (頁面存檔備份,存於互聯網檔案館). Cyanidecode.org. Retrieved on 2012-06-02.
- ^ Hydrogen Cyanide. Organisation for the Prohibition of Chemical Weapons. [2009-01-14]. (原始內容存檔於2018-07-17).
- ^ Dwork, D.; van Pelt, R. J. Auschwitz, 1270 to the present
 . Norton. 1996: 443. ISBN 978-0-393-03933-7.
. Norton. 1996: 443. ISBN 978-0-393-03933-7.
- ^ BLUE FUME. Chemical Factory Draslovka a.s. [2020-07-06]. (原始內容存檔於2021-02-16).
- ^ The Poison Garden website. [18 October 2014]. (原始內容存檔於2021-02-16).
- ^ Documentation for Immediately Dangerous to Life or Health Concentrations (IDLHs) – 74908. NIOSH. [2021-02-16]. (原始內容存檔於2021-03-24).
外部連結
[編輯]- 台灣綠健康十字網--氰化物
- Nauth, Alexander M.; Opatz, Till. Non-toxic cyanide sources and cyanating agents. Organic & Biomolecular Chemistry. 2019, 17 (1): 11–23. ISSN 1477-0520. doi:10.1039/C8OB02140F (英語).
- Institut national de recherche et de sécurité (1997). "Cyanure d'hydrogène et solutions aqueuses". Fiche toxicologique n° 4, Paris:INRS, 5pp. (PDF file, in French)
- International Chemical Safety Card 0492 (頁面存檔備份,存於互聯網檔案館)
- Hydrogen cyanide and cyanides (頁面存檔備份,存於互聯網檔案館) (CICAD 61)
- National Pollutant Inventory: Cyanide compounds fact sheet
- NIOSH Pocket Guide to Chemical Hazards (頁面存檔備份,存於互聯網檔案館)
- Department of health review
- Density of Hydrogen Cyanide gas (頁面存檔備份,存於互聯網檔案館)




