蛋白異構體

蛋白異構體(protein isoform)或蛋白異形體[1],又稱蛋白變異體(rotein variant[2]),是指源自單個基因或基因家族的一組高度相似的蛋白質,常具有相同或相似的生物學功能,是遺傳差異的結果[3]。
雖然大多數蛋白異構體功能相同或近似,但某些異構體具有獨特的功能。一組蛋白質異構體可以通過單個基因的選擇性剪接、可變啟動子的使用或其他轉錄後修飾形成,但通常不包括翻譯後修飾。(參閱蛋白質變體)通過RNA剪接機制,mRNA能夠選擇基因的不同蛋白質編碼片段(外顯子),甚至從RNA中選擇外顯子的不同部分,從而形成不同的mRNA序列。每個獨特的序列都會產生特定形式的蛋白質。
隨着蛋白質異構體的發現,由人類基因組計劃揭示的蛋白質編碼區數量較少,但生物體中蛋白質多樣性卻較豐富這一問題得到了解釋:由同一基因編碼的不同蛋白質可以增加蛋白質組的多樣性。RNA水平的異構體可以很輕鬆地通過cDNA轉錄研究來表徵。許多人類基因具有已確認的選擇性剪接異構體。據估計,人類中可以識別出約10萬個表達序列標籤(EST)。[2]蛋白質水平的異構體可以表現為整個結構域或較短環狀結構的缺失,通常位於蛋白質表面。[4]
定義
[編輯]單個基因能夠產生多種在結構和組成上均不同的蛋白質。[5][6]這一過程受mRNA的選擇性剪接所調節。然而,這一過程對人類蛋白質組多樣性的影響程度尚不清楚,因為mRNA轉錄異構體的豐度並不一定與蛋白質異構體的豐度相關。[7]通過比較蛋白質的三維結構,可用於幫助確定哪些異構體(如果有的話)是功能蛋白的產物,且AlphaFold已經預測了人類蛋白質組中大多數異構體的結構,並在isoform.io上公開發布。[8]翻譯異構體的特異性取決於蛋白質的結構或功能,以及產生它們的細胞類型和發育階段。[5][6]當蛋白質具有多個亞基且每個亞基都具有多個異構體時,確定特異性就變得更加複雜。
例如,單磷酸腺苷激活的蛋白激酶(AMPK)是一種在人類細胞中發揮不同作用的酶,它有3個亞基:[9]
- α,催化結構域,有兩種異構體:α1和α2,由PRKAA1和PRKAA2編碼
- β,調節結構域,有兩種異構體:β1和β2,由PRKAB1和PRKAB2編碼
- γ,調節結構域,有三種異構體:γ1、γ2和γ3,由PRKAG1、PRKAG2和PRKAG3編碼
在人類骨骼肌中,主要形式是α2β2γ1。[9]但在人類肝臟中,最豐富的形式是α1β2γ1。[9]
機制
[編輯]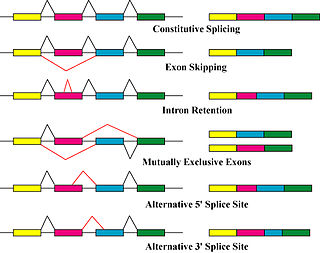
產生蛋白質異構體的主要機制是選擇性剪接和可變啟動子的使用,但由基因變化而引起的改變(如突變和多態性)有時也被認為是不同的異構體。[10]
選擇性剪接是產生mRNA轉錄異構體的主要轉錄後修飾過程,也是可能導致蛋白質多樣性的主要分子機制。[6]剪接體是細胞核內負責RNA切割和連接的大型核糖核蛋白分子機器,它會移除非編碼蛋白質的片段(內含子)。[11]
由於剪接是發生在轉錄和翻譯之間的過程,其主要影響主要通過基因組學技術進行研究。例如,微陣列分析和RNA測序已被用於識別選擇性剪接轉錄本並測量其豐度。[10]轉錄本豐度通常被用作蛋白質異構體豐度的替代指標,儘管使用凝膠電泳和質譜的蛋白質組學實驗已證明轉錄本和蛋白質數量之間的相關性通常很低,並且往往僅一種蛋白質異構體占主導地位。[12]一項2015年的研究指出,這種差異的原因很可能發生在翻譯之後,儘管其機制基本上是未知的。[13]因此,儘管選擇性剪接被認為是變異和疾病之間的重要紐帶,但沒有確鑿的證據表明它主要通過產生新的蛋白質異構體來發揮作用。[12]
選擇性剪接通常描述一種嚴格調控的過程,其中剪接機制有意生成選擇性轉錄本。然而,此類轉錄本也可能通過剪接錯誤產生,該過程稱為「剪切噪聲」,並且也可能被翻譯成蛋白質異構體。儘管約95%的多外顯子基因被認為是選擇性剪接的,但一項關於剪切噪聲的研究發現,大多數不同的低豐度轉錄本都是噪聲,並預測細胞中大多數選擇性轉錄本和蛋白質異構體並沒有功能上的相關性。[14]
其他轉錄和轉錄後調控步驟也可產生不同的蛋白質異構體。[15]當細胞的轉錄機制(RNA聚合酶、轉錄因子和其他酶)在不同的啟動子(基因附近作為初始結合位點的DNA區域)開始轉錄時,會發生可變啟動子的使用,從而產生略有不同的轉錄本和蛋白質異構體。
特性
[編輯]通常,一種蛋白質異構體被標記為規範序列是基於其普遍性和與其他物種的直系同源(或功能性同功)的相似性等標準。[16]蛋白質異構體被認為具有相似的功能特性,因為大多數蛋白質異構體具有相似的序列,並且與規範序列共享部分以至大部分外顯子。然而,一些蛋白質異構體表現出更大的差異(如通過反式剪接),並且可能與規範序列共享少部分甚至不共享外顯子。此外,它們可以具有不同的生物學效應,例如在極端情況下,一種異構體的功能可能促進細胞存活,而另一種異構體則可能促進細胞死亡;它們也可能具有相似的基本功能,只是在亞細胞定位上有所不同。[17]然而,2016年的一項研究對1492個基因的所有異構體進行了功能表徵,並確定大多數異構體表現為「功能性同源異構體」。作者在觀察到大多數異構體的功能不重疊後得出結論,異構體表現得就像不同的蛋白質。[18]由於這項研究是在體外細胞上進行的,因此尚不清楚表達的人類蛋白質組中的異構體是否具有這些特徵。此外,由於每個異構體的功能通常必須單獨確定,因此大多數已識別和預測的異構體的功能仍然是未知的。
相關概念
[編輯]糖形
[編輯]糖型是指僅在附着的聚糖數量或類型上有所不同的蛋白質異構體。糖蛋白通常由多種不同的糖型組成,這些糖型在附着的糖或寡糖上有所差異。這些變化可能是由於糖基化過程中的生物合成差異,或由於糖苷酶或糖基轉移酶的作用所致。糖型可以通過對分離的糖型進行詳細的化學分析來檢測,但更便捷的檢測方法是通過與凝集素的差異反應,如凝集素親和色譜法和凝集素親和電泳法。由糖型組成的糖蛋白的典型例子是血液蛋白,如血清類粘蛋白、抗胰蛋白酶和結合珠蛋白。在神經元黏附分子(NCAM)中涉及聚唾液酸(PSA)的糖型變異是一種不尋常的情況。
例子
[編輯]- G-肌動蛋白:儘管其性質保守,但它具有不同數量的異構體(哺乳動物中至少有六種)。
- 肌酸激酶:其在血液中的存在可用於幫助診斷心肌梗死,以三種異構體的形式存在,。
- 透明質酸合酶:負責透明質酸生成的酶,在哺乳動物細胞中有三種異構體。
- 尿苷雙磷酸葡萄糖醛酸轉移酶:這個酶超家族負責許多藥物、環境污染物和有毒內源性化合物的解毒途徑,已知有16種異構體編碼在人類基因組中。[19]
- G6PDA:在任何組織細胞中,其活性異構體的正常比例與G6PDG相同,為1:1。這正是增生中的正常異構體比例。在腫瘤形成過程中只發現其中一種異構體。
- 單胺氧化酶:這個酶家族是一類催化單胺氧化的酶,存在兩種異構體,分別是MAO-A和MAO-B。[20]
參見
[編輯]參考文獻
[編輯]- ^ 蛋白质异形体. 術語在線. 全國科學技術名詞審定委員會. (簡體中文)
- ^ 2.0 2.1 Brett D, Pospisil H, Valcárcel J, Reich J, Bork P. Alternative splicing and genome complexity. Nature Genetics. January 2002, 30 (1): 29–30. PMID 11743582. S2CID 2724843. doi:10.1038/ng803.
- ^ Schlüter H, Apweiler R, Holzhütter HG, Jungblut PR. Finding one's way in proteomics: a protein species nomenclature. Chemistry Central Journal. September 2009, 3: 11. PMC 2758878
 . PMID 19740416. doi:10.1186/1752-153X-3-11
. PMID 19740416. doi:10.1186/1752-153X-3-11  .
.
- ^ Kozlowski, L.; Orlowski, J.; Bujnicki, J. M. Structure Prediction for Alternatively Spliced Proteins. Alternative pre-mRNA Splicing. 2012: 582. ISBN 9783527636778. doi:10.1002/9783527636778.ch54.
- ^ 5.0 5.1 Andreadis A, Gallego ME, Nadal-Ginard B. Generation of protein isoform diversity by alternative splicing: mechanistic and biological implications. Annual Review of Cell Biology. 1987-01-01, 3 (1): 207–42. PMID 2891362. doi:10.1146/annurev.cb.03.110187.001231.
- ^ 6.0 6.1 6.2 Breitbart RE, Andreadis A, Nadal-Ginard B. Alternative splicing: a ubiquitous mechanism for the generation of multiple protein isoforms from single genes. Annual Review of Biochemistry. 1987-01-01, 56 (1): 467–95. PMID 3304142. doi:10.1146/annurev.bi.56.070187.002343.
- ^ Liu Y, Beyer A, Aebersold R. On the Dependency of Cellular Protein Levels on mRNA Abundance. Cell. April 2016, 165 (3): 535–50. PMID 27104977. doi:10.1016/j.cell.2016.03.014
 . hdl:20.500.11850/116226
. hdl:20.500.11850/116226  .
.
- ^ Sommer, Markus J.; Cha, Sooyoung; Varabyou, Ales; Rincon, Natalia; Park, Sukhwan; Minkin, Ilia; Pertea, Mihaela; Steinegger, Martin; Salzberg, Steven L. Structure-guided isoform identification for the human transcriptome. eLife. 2022-12-15, 11: e82556. PMC 9812405
 . PMID 36519529. doi:10.7554/eLife.82556
. PMID 36519529. doi:10.7554/eLife.82556  (英語).
(英語).
- ^ 9.0 9.1 9.2 Dasgupta B, Chhipa RR. Evolving Lessons on the Complex Role of AMPK in Normal Physiology and Cancer. Trends in Pharmacological Sciences. March 2016, 37 (3): 192–206. PMC 4764394
 . PMID 26711141. doi:10.1016/j.tips.2015.11.007 (English).
. PMID 26711141. doi:10.1016/j.tips.2015.11.007 (English).
- ^ 10.0 10.1 Kornblihtt AR, Schor IE, Alló M, Dujardin G, Petrillo E, Muñoz MJ. Alternative splicing: a pivotal step between eukaryotic transcription and translation. Nature Reviews Molecular Cell Biology. March 2013, 14 (3): 153–65. PMID 23385723. S2CID 54560052. doi:10.1038/nrm3525. hdl:11336/21049
 (英語).
(英語).
- ^ Lee Y, Rio DC. Mechanisms and Regulation of Alternative Pre-mRNA Splicing. Annual Review of Biochemistry. 2015-01-01, 84 (1): 291–323. PMC 4526142
 . PMID 25784052. doi:10.1146/annurev-biochem-060614-034316.
. PMID 25784052. doi:10.1146/annurev-biochem-060614-034316.
- ^ 12.0 12.1 Tress ML, Abascal F, Valencia A. Alternative Splicing May Not Be the Key to Proteome Complexity. Trends in Biochemical Sciences. February 2017, 42 (2): 98–110. PMC 6526280
 . PMID 27712956. doi:10.1016/j.tibs.2016.08.008.
. PMID 27712956. doi:10.1016/j.tibs.2016.08.008.
- ^ Battle A, Khan Z, Wang SH, Mitrano A, Ford MJ, Pritchard JK, Gilad Y. Genomic variation. Impact of regulatory variation from RNA to protein. Science. February 2015, 347 (6222): 664–7. PMC 4507520
 . PMID 25657249. doi:10.1126/science.1260793.
. PMID 25657249. doi:10.1126/science.1260793.
- ^ Pickrell JK, Pai AA, Gilad Y, Pritchard JK. Noisy splicing drives mRNA isoform diversity in human cells. PLOS Genetics. December 2010, 6 (12): e1001236. PMC 3000347
 . PMID 21151575. doi:10.1371/journal.pgen.1001236
. PMID 21151575. doi:10.1371/journal.pgen.1001236  .
.
- ^ Smith LM, Kelleher NL. Proteoform: a single term describing protein complexity. Nature Methods. March 2013, 10 (3): 186–7. PMC 4114032
 . PMID 23443629. doi:10.1038/nmeth.2369 (英語).
. PMID 23443629. doi:10.1038/nmeth.2369 (英語).
- ^ Li HD, Menon R, Omenn GS, Guan Y. Revisiting the identification of canonical splice isoforms through integration of functional genomics and proteomics evidence (PDF). Proteomics. December 2014, 14 (23–24): 2709–18. PMC 4372202
 . PMID 25265570. doi:10.1002/pmic.201400170.
. PMID 25265570. doi:10.1002/pmic.201400170.
- ^ Sundvall M, Veikkolainen V, Kurppa K, Salah Z, Tvorogov D, van Zoelen EJ, Aqeilan R, Elenius K. Cell death or survival promoted by alternative isoforms of ErbB4. Molecular Biology of the Cell. December 2010, 21 (23): 4275–86. PMC 2993754
 . PMID 20943952. doi:10.1091/mbc.E10-04-0332.
. PMID 20943952. doi:10.1091/mbc.E10-04-0332.
- ^ Yang X, Coulombe-Huntington J, Kang S, Sheynkman GM, Hao T, Richardson A, et al. Widespread Expansion of Protein Interaction Capabilities by Alternative Splicing. Cell. February 2016, 164 (4): 805–17. PMC 4882190
 . PMID 26871637. doi:10.1016/j.cell.2016.01.029.
. PMID 26871637. doi:10.1016/j.cell.2016.01.029.
- ^ Barre L, Fournel-Gigleux S, Finel M, Netter P, Magdalou J, Ouzzine M. Substrate specificity of the human UDP-glucuronosyltransferase UGT2B4 and UGT2B7. Identification of a critical aromatic amino acid residue at position 33. The FEBS Journal. March 2007, 274 (5): 1256–64. PMID 17263731. doi:10.1111/j.1742-4658.2007.05670.x
 .
.
- ^ Pathoma, Fundamentals of Pathology
