巴克明斯特富勒烯
| 巴克明斯特富勒烯 | |||
|---|---|---|---|
| |||
| IUPAC名 (C60-Ih)[5,6]fullerene | |||
| 别名 | 巴克球;足球烯;富勒烯-C60;[60]富勒烯 | ||
| 识别 | |||
| CAS号 | 99685-96-8 | ||
| PubChem | 123591 | ||
| ChemSpider | 110185 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | XMWRBQBLMFGWIX-UHFFFAOYAU | ||
| Beilstein | 5901022 | ||
| ChEBI | 33128 | ||
| 性质 | |||
| 化学式 | C60 | ||
| 摩尔质量 | 720.64 g·mol−1 | ||
| 外观 | 黑色固体 | ||
| 密度 | 1.65 g/cm3 | ||
| 熔点 | 600 °C(873 K) | ||
| 溶解性(水) | 不溶于水 | ||
| 结构 | |||
| 晶体结构 | 面心立方, cF1924 | ||
| 空间群 | Fm3m, No. 225 | ||
| 晶格常数 | a = 1.4154 nm | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
巴克明斯特富勒烯(英语:Buckminsterfullerene),分子式为C60,是富勒烯家族的一种,球状分子,是最容易制备的一种,1985年英国化学家哈罗德·沃特尔·克罗托博士和美国科学家理察·斯莫利在莱斯大学制备出了第一种富勒烯。[1]
发现
[编辑]1985年,英国化学家哈罗德·沃特尔·克罗托博士和美国科学家理查德·斯莫利等人在莱斯大学于氦气流中以激光汽化蒸发石墨实验中首次制得由60个碳组成的碳原子簇结构分子“C60”。为此,克罗托博士获得1996年度诺贝尔化学奖。在1990年前,关于富勒烯的研究都集中于理论研究[2],因为没有足量的富勒烯用于实验,直到1990年后,Kriischmer等人第一次报道了大量合成C60的方法[3][4],才使得C60的研究得以大量展开。因为这个分子与建筑学家巴克明斯特·富勒设计的1967年世界博览会美国馆球形圆顶薄壳建筑很相似,为了表达对他的敬意,将其命名为“巴克明斯特·富勒烯”(buckminster fullerene),昵称“巴克球”(buckyball)[1]。
-
建筑学家理查德·巴克明斯特·富勒设计的美国万国博览馆球形圆顶薄壳建筑
-
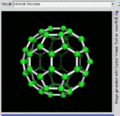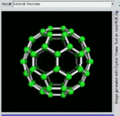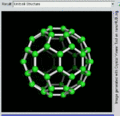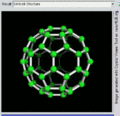
C60的旋转视图
-
C60粉末
结构
[编辑]
后来通过质谱分析、X射线分析后证明,C60的分子结构的确为球形32面体,它是由60个碳原子以20个六员环和12个五员环连接而成的具有30个碳碳双键(C=C)的足球状空心对称分子,所以,富勒烯也被称为足球烯。
1991年,日本科学家饭岛澄男另外发现管状的富勒烯称为“巴克管”(单壁的奈米碳管(SMNT),全世界最小的人工中空管,就是巴克管)。 在数学上,富勒烯的结构都是以五边形和六边形面组成的凸多面体。最小的富勒烯是C20,有正十二面体的构造。没有22个顶点的富勒烯。之后都存在C2n的富勒烯,n = 12, 13, 14 ...。暂时有1812种富勒烯。
它是一系列含有多个碳原子的笼状原子簇的总称,其中最有名且最先发现的是碳六十分子(C60),它有个特别的名字:buckminster fullerene。所有富勒烯结构的五边形个数为12个,六边形个数为(n - 10)。
性质
[编辑]物理性质
[编辑]密度
[编辑]C60的密度大约为1.7g/cm3。
溶解性
[编辑]
C60在大部分溶剂中溶解性很差,通常用甲苯、氯苯或二硫化碳等芳香性溶剂溶解。纯富勒烯的溶液通常是紫色,浓度大则是紫红色。富勒烯是迄今发现的唯一在室温下溶于常规溶剂的碳同素异形体。
- 1-氯萘 (51 mg/mL)
- 1-甲基萘 (33 mg/mL)
- 1,2-二氯苯 (24 mg/mL)
- 1,2,4-三氯苯 (18 mg/mL)
- 四氢萘 (16 mg/mL)
- 二硫化碳 (8 mg/mL)
- 1,2,3-三溴丙烷 (8 mg/mL)
- 溴仿 (5 mg/mL)
- 异丙苯 (4 mg/mL)
- 甲苯 (3 mg/mL)
- 苯 (1.5 mg/mL)
- 环己烷 (1.2 mg/mL)
- 四氯化碳 (0.4 mg/mL)
- 氯仿 (0.25 mg/mL)
- 正己烷 (0.046 mg/mL)
- 四氢呋喃 (0.006 mg/mL)
- 乙腈 (0.004 mg/mL)
- 甲醇 (0.000 04 mg/mL)
- 水 (1.3×10−11 mg/mL)
另见
[编辑]参考文献
[编辑]- ^ 1.0 1.1 Richard E. Smalley, Robert F. Curl, Jr., and Harold W. Kroto. Chemical Heritage Foundation. [2016-02-03]. (原始内容存档于2016-01-19) (英语).
- ^ J. Phys. Chem. 1992,96, 5151-5156
- ^ Krstschmer, W.; Fostiropoulos, K.; Huffman, R. Chem. Phys. Lerr.1990, 170, 167.
- ^ Kriitschmer, W.; Lamb, L.D.; Fostiropoulos, K.; Huffman, D. R.Nature 1990, 347, 354.
- ^ Bezmel'nitsyn, V N; Eletskii, Aleksandr V; Okun', M V. Fullerenes in solutions. Physics-Uspekhi. 1998, 41: 1091. doi:10.1070/PU1998v041n11ABEH000502.
- ^ Ruoff, R. S.; Tse, Doris S.; Malhotra, Ripudaman; Lorents, Donald C. Solubility of fullerene (C60) in a variety of solvents. The Journal of Physical Chemistry. 1993, 97: 3379. doi:10.1021/j100115a049.