亨利反应
| Henry反应 | |
|---|---|
| 命名根据 | Louis Henry |
| 反应类型 | 偶联反应 |
| 标识 | |
| 有机化学网站对应网页 | henry-reaction |
| RSC序号 | RXNO:0000086 |
亨利反应(英语:Henry reaction)是有机合成中用以构建碳-碳键的人名反应,由硝基烷烃和醛或酮在碱性条件下偶联产生β-硝基醇[1][2][3]。 该反应于1895年由比利时化学家路易斯·亨利(Louis Henry,1834-1913)发现,是有机化学中常见的反应,可以在后续步骤中用于合成硝基烯烃、α-硝基酮、β-氨基醇等结构。Henry反应与羟醛反应相似,故而有时会被称为硝基羟醛反应(nitroaldol reaction)[2][4]。

机理
[编辑]许多硝基烷烃的α-H呈弱酸性,pKa≈17 [5][6],Henry反应起始于碱进攻硝基烷烃的α-H形成氮酸酯结构。尽管在此共振结构中有碳负离子与硝基两个亲核中心,据悉[7]偶联的关键步却是由碳进攻羰基进行,产生的β-硝基醇盐从碱的共轭酸处质子化,最终得到β-硝基醇产物。Henry反应的每一步都是可逆的[2][3]。

空间构型
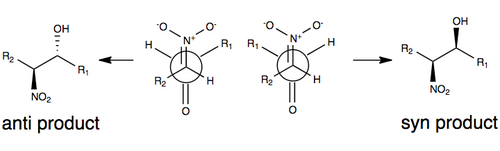
[编辑]Henry反应产物的立体选择性由取代基的空间效应所影响,在如图所示的非对映异构体的纽曼式中,产物的立体选择性同时受R取代基的大小和硝基、羰基的极性取向[註 1]影响。通常认为在反应的过渡态时,底物R基团的空间效应越大,反应就越容易得到反式产物[3][8]。由于反应的可逆性和硝基取代碳易形成差向异构体的原因,Henry反应的产物通常是对映异构体与非对映异构体的混合物。
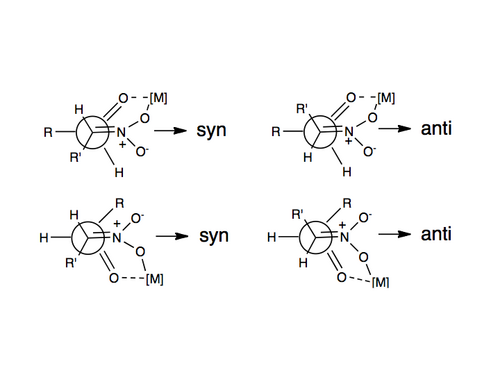
1992年,柴崎正勝报告了使用柴崎催化剂进行的对映选择性硝基羟醛反应[9],通过使用手性金属催化剂,硝基和羰基与中心金属配位结合,是诱导Henry反应得到对映或非对映选择性产物的最常用方法之一,已知的可用金属包括锌、钴、铜、镁和铬[10]。
特点
[编辑]Henry反应仅需要使用催化量的碱即可驱动反应进行,并且反应条件和碱的类型非常宽泛,如离子性的碱(如碱金属水化物、醇盐、碳酸盐和氟化物等)或有机碱(如胍、酶、DBU、Verkade碱等),此外使用不同的碱与溶剂不会对反应过程产生大的影响[2]。
限制
[编辑]Henry反应的主要缺点是,非常容易发生副反应。除去反应本身每一步都可逆的影响,产物β-硝基醇也容易脱水。对某些空间位阻大的底物,甚至可能发生碱催化的自缩合Cannizzaro反应 [2]。

改进
[编辑]Henry反应有许多改良方法,其中以调整反应条件 (高压、无溶剂、非均相反应等)来提高化学及区域选择性[2]、使用手性金属催化剂以诱导对映或非对映选择性[10]、氮杂环不对称Hnery反应[11](用于合成邻二胺)为最多的改进方法。
应用
[编辑]在1999年,Menzel及其同事开发了一条合成L-acosamine的路线,这是一类蒽环类药物的糖类亚基化合物[12][13]。

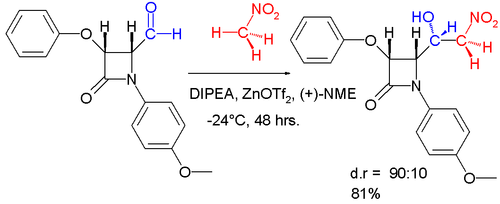
Henry反应可以作为可控的羟醛反应,可用于不对称合成对映选择性的加成产物,例如苯甲醛和硝基甲烷在三氟甲磺酸锌作为路易斯酸、DIPEA、N-甲基麻黄碱((+)-NME)作为手性配体的催化系统中反应[14]。下图所示的是非对映选择性Henry反应[15]:
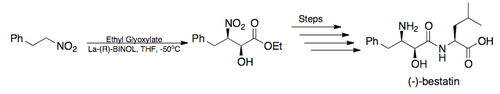
在2005年,Barua及其同事柴崎正勝以不对称Henry反应作为关键步,全合成了强效氨肽酶抑制剂(-)-Bestatin[註 2],总体产率为26%[12][16]:
在2006年,Hiemstra及其同事研究了奎宁衍生物催化的不对称芳香醛-硝基甲烷Henry反应,通过使用特定的催化剂,能够诱导产生对应的异构体[17]。

在2006年,Purkarthofer等人发现从橡胶树处得到的(S)-羟基腈裂合酶催化合成(S)- β-硝基醇的生物催化Henry反应[18]。随后的2011年,Fuhshuku和Asano发现了拟南芥中的(R)-羟基腈裂合酶可以催化芳香醛和硝基甲烷合成(R)- β-硝基醇[19]。
备注
[编辑]参考文献
[编辑]- ^ Henry, Louis. Formation synthétique d'alcools nitrés [Synthetic formation of nitrated alcohols]. Comptes rendus. 1895, 120: 1265–1268 [2022-01-04]. (原始内容存档于2022-01-04).
- ^ 2.0 2.1 2.2 2.3 2.4 2.5 Kurti, L.; Czako, B. Strategic Applications of Named Reactions in Organic Synthesis. Burlington, MA: Elsevier Academic Press. 2005: 202–203. ISBN 978-0-12-369483-6.
- ^ 3.0 3.1 3.2 Noboro, Ono. The Nitro Group in Organic Synthesis. New York, NY: Wiley-VCH. 2001: 30–69. ISBN 978-0-471-31611-4.
- ^ Wurtz, M.A. Sur un aldéhyde-alcool. Bull. Soc. Chim. Fr. 1872, 17: 436–442 [2022-01-04]. (原始内容存档于2017-04-07).
- ^ Reich, Hans. Bordwell pKa table: "Nitroalkanes". University of Wisconsin Chemistry Department. [17 January 2016]. (原始内容存档于2008-10-09).
- ^ Matthews, Walter; et al. Equilibrium acidities of carbon acids. VI. Establishment of an absolute scale of acidities in dimethyl sulfoxide solution. Journal of the American Chemical Society. 1975, 97 (24): 7006. doi:10.1021/ja00857a010.
- ^ Bersohn, Malcolm. C versus O Alkylation in the Case of a Stable Cation. J. Am. Chem. Soc. 1961, 83 (9): 2136–2138. doi:10.1021/ja01470a022.
- ^ Begona, L., Arrieta, A., Morao, I., Cossio, F.P. Ab Initio Models for the Nitroaldol (Henry) Reaction. Chem. Eur. J. 1997, 3 (1): 20–28. doi:10.1002/chem.19970030105.
- ^ Sasai, Hiroaki; Suzuki, Takeyuki; Arai, Shigeru; Arai, Takayoshi; Shibasaki, Masakatsu. Basic character of rare earth metal alkoxides. Utilization in catalytic carbon-carbon bond-forming reactions and catalytic asymmetric nitroaldol reactions. Journal of the American Chemical Society. 1 May 1992, 114 (11): 4418–4420. doi:10.1021/ja00037a068.
- ^ 10.0 10.1 Seayad, J., List, B. Asymmetric organocatalysis. Org. Biomol. Chem. 2005, 3 (5): 719–724. PMID 15731852. doi:10.1039/b415217b.
- ^ Westermann, B. Asymmetric catalytic aza-Henry reactions leading to 1,2-diamines and 1,2-diaminocarboxylic acids. Angew. Chem. Int. Ed. Engl. 2003, 42 (2): 151–153. PMID 12532343. doi:10.1002/anie.200390071.
- ^ 12.0 12.1 Luzzio, F.A. The Henry Reaction: recent examples. Tetrahedron. 2001, 57 (22): 915–945. doi:10.1002/chin.200122233.
- ^ Menzel, A., Ohrlein, R., Griesser, H., Wehner, V., Jager, V. A Short Synthesis of L-Acosamine Based on Nitroaldol Addition (Henry Reaction). Analysis of the Key Step Concerning Solvent and Temperature Effects. Synthesis. 1999, 9 (45): 1691–1702. doi:10.1002/chin.199945325.
- ^ Palomo, Claudio; Oiarbide, Mikel; Laso, Antonio. Enantioselective Henry Reactions under Dual Lewis Acid/Amine Catalysis Using Chiral Amino Alcohol Ligands. Angewandte Chemie. 2005, 44 (25): 3881–3884. PMID 15892142. doi:10.1002/anie.200463075.
- ^ Alcaide, Benito; Almendros, Pedro; Luna, Amparo; Paz de Arriba, M.; Rosario Torresc, M. Organocatalyzed diastereoselective Henry reaction of enantiopure 4-oxoazetidine-2-carbaldehydes (PDF). Arkivoc. 2007, 2007 (iv): 285–296. doi:10.3998/ark.5550190.0008.425
 .
.
- ^ Gogoi, N., Boruwa, J., Barua, N.C. A total synthesis of (–)-bestatin using Shibasaki's asymmetric Henry reaction. Tetrahedron Letters. 2005, 46 (44): 7581–7582. doi:10.1016/j.tetlet.2005.08.153.
- ^ Marcelli, T., van der Haas, R., van Maarseveen, J.H., Hiemstra, H. Asymmetric Organocatalytic Henry Reaction. Angew. Chem. Int. Ed. 2006, 45 (6): 929–931. PMID 16429453. doi:10.1002/anie.200503724.
- ^ Purkarthofer, T., Gruber, K., Gruber-Khadjawi, M., Waich, K., Skranc, W., Mink, D. and Griengl, H. A Biocatalytic Henry Reaction—The Hydroxynitrile Lyase from Hevea brasiliensis Also Catalyzes Nitroaldol Reactions.. Angewandte Chemie. 2006, 45 (21): 3454–3456. PMID 16634109. doi:10.1002/anie.200504230.
- ^ Fuhshuku K, Asano Y. Synthesis of (R)-β-nitro alcohols catalyzed by R-selective hydroxynitrile lyase from Arabidopsis thaliana in the aqueous-organic biphasic system.. J. Biotechnol. 2011, 153 (3–4): 153–159. PMID 21439333. doi:10.1016/j.jbiotec.2011.03.011.
