四甲基錫
外觀
| 四甲基錫 | |||
|---|---|---|---|
| |||
| IUPAC名 Tetramethylstannane[1] | |||
| 別名 | 四甲錫 | ||
| 識別 | |||
| CAS號 | 594-27-4 | ||
| PubChem | 11661 | ||
| ChemSpider | 11171 | ||
| SMILES |
| ||
| Beilstein | 3647887 | ||
| Gmelin | 1938 | ||
| UN編號 | 3384 | ||
| EINECS | 209-833-6 | ||
| ChEBI | 30420 | ||
| RTECS | WH8630000 | ||
| 性質 | |||
| 化學式 | C4H12Sn | ||
| 摩爾質量 | 178.85 g·mol−1 | ||
| 外觀 | 無色液體 | ||
| 密度 | 1.291 g cm−3 | ||
| 熔點 | -54 °C(219 K) | ||
| 沸點 | 74°C至 76 °C | ||
| 危險性 | |||
| 警示術語 | R:R26/27/28, R50/53 | ||
| 安全術語 | S:S26, S27, S28, S45, S60, S61 | ||
| 歐盟分類 | |||
| NFPA 704 | |||
| 相關物質 | |||
| 相關化學品 | 四丁基錫 四乙基錫 新戊烷 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
四甲基錫是一種有機金屬化合物 ,化學式 (CH3)4Sn。這種液體是最簡單的有機錫化合物之一,它對於過渡金屬介導的醯氯到甲基酮的轉化以及芳香鹵化烴到芳香甲基酮的轉化是有用的。它具有揮發性,且有毒,因此在實驗室中使用時應小心。
製備和結構
[編輯]四甲基錫可以由格氏試劑甲基碘化鎂和 SnCl4反應而成,[2] 而原料四氯化錫可以由氯氣和錫反應而成。[3]
- 4 CH3MgI + SnCl4 → (CH3)4Sn + 4 MgICl
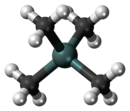
在四甲基錫里,錫原子被四個甲基包圍,是一種四面體型分子,可以看作是新戊烷的較重版本。
應用
[編輯]其它有機錫化合物的前體
[編輯]四甲基錫是三甲基氯化錫(和相關的甲基錫鹵化物)的前體,後者是其他有機錫化合物的前體。 這些甲基氯化錫是通過所謂的Kocheshkov重分布反應製備的。因此,SnMe4 和 SnCl4 可以在 100 °C 至 200 °C 之間反應,形成 Me3SnCl:
- SnCl4 + 3 SnMe4 → 4 Me3SnCl
另一種得到三甲基氯化錫的方法是反應氯化汞和 SnMe4 而成:[2]
- 4 HgCl2 + 4 SnMe4 → 4 Me3SnCl + 4 MeHgCl
在 PVC中,各種甲基錫化合物被用作穩定劑的前體。二巰基和三巰基錫化合物可用於抑制脫氯化氫反應,而這是PVC光解和熱降解的途徑。 [3]
表面官能化
[編輯]四甲基錫會在 277 °C (550 K) 汽化並分解。Me4Sn 蒸汽會和二氧化矽反應,生成含有 Me3Sn 基團的固體。
- Me4Sn + ≡SiOH → ≡SiOSnMe3 + MeH
其它的烷基錫也可以發生這個反應。在類似的方法中,四甲基錫已被用於在低至-90℃的溫度下使某些沸石官能化。 [4]
在有機合成中的應用
[編輯]在有機合成中,四甲基錫與醯氯會進行鈀催化偶聯反應,得到甲基酮: [5]
- SnMe4 + RCOCl → RCOMe + Me3SnCl
參考資料
[編輯]- ^ Tetramethyltin | C4H12Sn. ChemSpider. [2013-09-15]. (原始內容存檔於2019-03-30).
- ^ 2.0 2.1 Scott, W. J.; Jones, J. H.; Moretto, A. F. Tetramethylstannane. Encyclopedia of Reagents for Organic Synthesis. 2002. ISBN 0471936235. doi:10.1002/047084289X.rt070.
- ^ 3.0 3.1 Thoonen, S. H. L.; Deelman, B.; van Koten, G. Synthetic Aspects of Tetraorganotins and Organotin(IV) Halides. Journal of Organometallic Chemistry. 2004, 689 (13): 2145–2157. doi:10.1016/j.jorganchem.2004.03.027.
- ^ Davies, A. G. Tin Organometallics. Robert H. Crabtree; D. Michael P. Mingos (編). Comprehensive Organometallic Chemistry III. Elsevier. 2008: 809–883. ISBN 9780080450476. doi:10.1016/B0-08-045047-4/00054-6.
- ^ Labadie, J. & Stille, J. Mechanisms of the palladium-catalyzed couplings of acid chlorides with organotin reagents. J. Am. Chem. Soc. 1983, 105 (19): 6129. doi:10.1021/ja00357a026.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||