夏普莱斯不对称环氧化反应
| 夏普莱斯不对称环氧化反应 | |
|---|---|
| 命名根据 | 巴里·夏普莱斯 |
| 反应类型 | 成环反应 |
| 标识 | |
| 有机化学网站对应网页 | sharpless-epoxidation |
| RSC序号 | RXNO:0000141 |
夏普莱斯不对称环氧化反应(英文:Sharpless epoxidation)是一种不对称选择的化学反应,可以用来从一级或者二级烯丙醇制备2,3-环氧醇。[1][2] 它是以主要发明人巴里·夏普莱斯和香月勗命名的不对称环氧化反应。该反应大约在1970年代开始得到系统研究,80年代后日臻成熟。[1][2]

环氧化产物的立体化学是由反应中使用的手性酒石酸酯的非对映体(通常为酒石酸二乙酯或者酒石酸二异丙酯)决定的。氧化试剂为过氧叔丁醇。反应中使用一个催化剂可以形成产物的对映体选择性,该催化剂通过四异丙氧基钛和酒石酸二乙酯反应获得。反应在存在3Å分子筛(3Å MS)的条件下只需5-10 mol%的催化剂量。[3]
夏普莱斯环氧化的成功取决于五大主要原因:首先,环氧化合物能够简单的转化为二醇、氨基醇或者醚,所以在天然产物的全合成当中形成手性的环氧化合物是非常重要的步骤。第二,该反应能够和许多一级或者二级烯丙醇反应。第三,夏普莱斯环氧化的产物通常具有超过90%的ee值(对映体过量)。第四,通过夏普莱斯环氧化模型可以预测出产物的手性。最后,夏普莱斯环氧化的反应试剂都是商业化的且非常廉价易得。[4]
巴里·夏普莱斯因在不对称氧化方面的成就分享了2001年度的诺贝尔化学奖。与他共同获奖的还有:威廉·斯坦迪什·诺尔斯和野依良治。
催化剂结构
[编辑]催化剂的结构直到现在还未非常确定。还未有研究能够完全排除其他假定的催化剂。无论如何,所有的研究都表明催化剂是一种[Ti(tartrate)(OR)2] 的二聚体。催化剂模型通过X-射线鉴定了结构。[9]
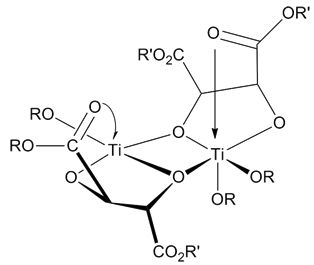
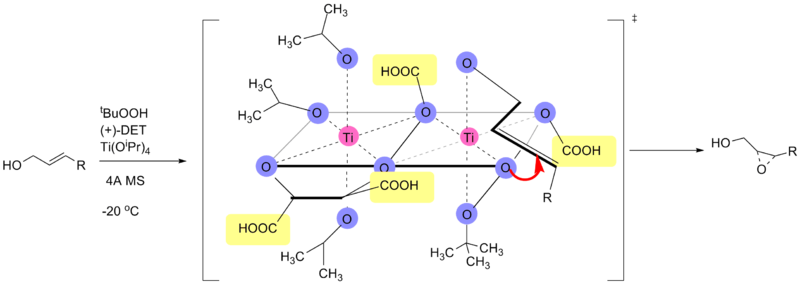
机理
[编辑]该反应是以四价钛酸酯路易斯酸介导,以过氧化氢衍生物为氧化剂(常为叔丁基过氧化氢),以酒石酸乙酯为立体诱导配体而进行的烯烃环氧化反应。
反应选择性
[编辑]夏普莱斯环氧化反应的产物可以通过下列的模型进行预测:确定一个双键平面,并在双键平面上画出一个与之围绕的矩形。朝着右下角画出烯丙醇羟基,然后按照分子结构在其他矩形角上画出其他取代基。在氧化方向上,(-)酒石酸乙酯优先从上方和双键反应,而(+)酒石酸乙酯优先从下方与分子进行反应。这种模型对于大多数的烯烃化合物都有效。而当R1基团较大时选择性会降低,当R2和R3基团较大时选择性会提高。[1]


烯丙位的1,2-二醇的环氧化产物无法通过这个模型来预测。[10]

动力学拆分
[编辑]夏普莱斯环氧化同样可以把一组消旋的二级醇(2,3-环氧醇)进行动力学拆分。虽然在动力学拆分过程的收率不能高于50%,然而在有些反应中ee值能够接近100%。[11][12]

合成实例
[编辑]夏普莱斯环氧化对于大多数的一级或者二级烯丙醇都是有效的。除了上述提到的以外,酒石酸二烷基酯对于双键优先进攻的方向性和双键的取代基是无关的。[1]为了展示夏普莱斯环氧化的应用,夏普莱斯小组合成了许多天然产物中间体:酒霉素、红霉素、白三烯C-1和(+)-环氧十九烷。[13]

作为在当时为数不多的高不对称选择性反应,许多针对2,3-环氧醇的合成都进行了开发和研究。[14]
夏普莱斯环氧化已经被用于全合成碳水化合物、萜烯、白三烯、信息素、和抗生素。[4]
意义
[编辑]方便、高效、高选择性、调控性良好的不对称合成反应。
参见
[编辑]参考文献
[编辑]- ^ 1.0 1.1 1.2 1.3 Katsuki, T.; Sharpless, K. B. J. Am. Chem. Soc. 1980, 102, 5974. (doi:10.1021/ja00538a077)
- ^ 2.0 2.1 Hill, J. G.; Sharpless, K. B.; Exon, C. M.; Regenye, R. Org. Syn., Coll. Vol. 7, p.461 (1990); Vol. 63, p.66 (1985). (Article (页面存档备份,存于互联网档案馆))
- ^ Gao, Y.; Hanson, R. M.; Klunder, J. M.; Ko, S. Y.; Masamune, H.; Sharpless, K. B. J. Am. Chem. Soc. 1987, 109, 5765-5780. (doi:10.1021/ja00253a032)
- ^ 4.0 4.1 Uetikon, C. F. Synthesis (Stuttgart) 1986, 88-116.
- ^ Johnson, R. A.; Sharpless, K. B. Comp. Org. Syn. 1991, 7, 389-436. (Review)
- ^ Hüft, E. Top. Curr. Chem. 1993, 164, 63-77. (Review)
- ^ Katsuki, T.; Martin, V. S. Org. React. 1996, 48, 1-300. (Review)
- ^ Pfenninger, A. Synthesis 1986, 89-116. (Review)
- ^ Finn, M. G.; Sharpless, K. B. J. Am. Chem. Soc. 1991, 113, 113-126. (doi:10.1021/ja00001a019)
- ^ Takano, S.; Iwabuchi, Y.; Ogasawara, K. J. Am. Chem. Soc. 1991, 113, 2786-2787. (doi:10.1021/ja00007a082)
- ^ Kitano, Y.; Matsumoto, T.; Sato, F. Tetrahedron 1988, 44, 4073-4086.
- ^ Martin, V.; Woodard, S.; Katsuki, T.; Yamada, Y.; Ikeda, M.; Sharpless, K. B. J. Am. Chem. Soc. 1981, 103, 6237-6240. (doi:10.1021/ja00410a053)
- ^ Rossiter, B.; Katsuki, T.; Sharpless, K. B. J. Am. Chem. Soc. 1981, 103, 464-465. (doi:10.1021/ja00392a038)
- ^ Sharpless, K. B.; Behrens, C. H.; Katsuki, T.; Lee, A. W. M.; Martin, V. S.; Takatani, M.; Viti, S.M.; Walker, F. J.; Woodard, S. S. Pure Appl. Chem. 1983, 55, 589.
