噁唑
外观
(重定向自恶唑)
| 㗁唑 | |
|---|---|
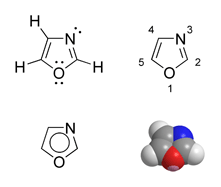
| |
| IUPAC名 1,3-oxazole 1,3-㗁唑 | |
| 英文名 | Oxazole |
| 识别 | |
| CAS号 | 288-42-6 |
| PubChem | 9255 |
| ChemSpider | 8898 |
| SMILES |
|
| InChI |
|
| InChIKey | ZCQWOFVYLHDMMC-UHFFFAOYAD |
| EINECS | 206-020-8 |
| ChEBI | 35597 |
| MeSH | D010080 |
| 性质 | |
| 化学式 | C3H3NO |
| 摩尔质量 | 69.06 g·mol⁻¹ |
| 密度 | 1.050 g/cm3 |
| 沸点 | 69-70 °C |
| pKa | 0.8 (其共轭酸) [1] |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
㗁唑(Oxazole)是一大类有机杂环化合物的母体,含有一个氧杂原子和一个氮杂原子。[2]
生物化学
[编辑]在生物化学中,由丝氨酸和苏氨酸非核糖体多肽环化然后氧化就可以得到噁唑。
在生物体内,噁唑并不像噻唑那样普遍,后者是噁唑的类似物,用硫原子取代噁唑中的氧原子。
性质
[编辑]噁唑是一个芳香性化合物,但是其芳香性不及噻唑。噁唑也是一个弱碱,其共轭酸的pKa值是0.8,相比而言,咪唑的共轭酸的pKa是7。
有机合成
[编辑]对于噁唑,经典的有机合成方法有以下几种:
- Robinson-Gabriel合成:对2-酰氨酮脱水得到噁唑。
- 费歇尔噁唑合成:通过氰醇和醛合成噁唑。
- Bredereck反应:α-卤代酮与甲酰胺合成噁唑。
- 其他文献上提到过的方法:
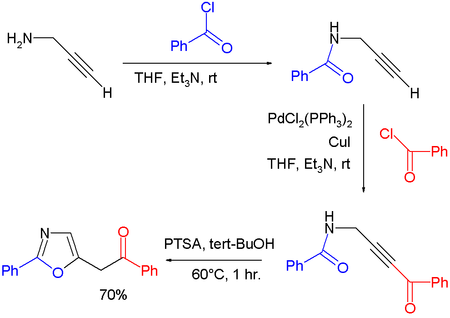
- 噁唑也能够通过某些炔丙基胺的环化异构化生成。 在一个实验中[3] ,化学家使用一次性合成法合成了噁唑,过程是首先用炔丙基胺与苯甲酰氯缩合形成酰胺,然后经过一个端基炔的Sonogashira偶联反应,然后再加入同样当量的苯甲酰氯,最后由对甲基苯磺酸催化完成环化异构化形成产物。

有机反应
[编辑]- 在C2位置对噁唑进行去质子化常常伴随着异腈化合物的开环。
- 在有活化基的情况下可以在C5发生亲电芳香取代反应。
- 若C2位置有离去集团,则可以发生亲核芳香取代反应。
- 由噁唑双烯发生狄尔斯-阿尔德反应,然后脱去氧原子形成嘧啶。
- 4-酰基噁唑的康福斯重排是一个热重排反应,酰基部分和C5发生重排。
- 多种氧化反应。其中一例 [5]是对4,5-二苯基噁唑的氧化。将其与三当量的硝酸铈铵反应生成甲酰胺与苯甲酸:

在平衡的半反应中可以看出,对于一当量的噁唑,该反应消耗了三当量的水,产生了四个质子和四个电子,后者是来自CeIV。
参见
[编辑]- 异噁唑,氮在2位的类似物。
- 咪唑,氧被氮取代了的类似物。
- 噻唑,氧被硫取代了的类似物
- 苯并噁唑,噁唑于其他环相连。
- 吡咯,没有氧原子的一个类似物。
- 呋喃,没有氮原子的一个类似物。
- 噁唑啉,其中一个双键被还原。
- 噁唑烷,两个双键均被还原。
- 芳香环
参考文献
[编辑]- ^ Zoltewicz, J. A. & Deady, L. W. Quaternization of heteroaromatic compounds. Quantitative aspects. Adv. Heterocycl. Chem. 22, 71-121 (1978).
- ^ Heterocyclic Chemistry TL Gilchrist, The Bath press 1985 ISBN 0-582-01421-2
- ^ A new consecutive three-component oxazole synthesis by an amidation–coupling–cycloisomerization (ACCI) sequence Eugen Merkul and Thomas J. J. Müller Chem. Commun., 2006, 4817 - 4819, doi:10.1039/b610839c
- ^ Fully Automated Continuous Flow Synthesis of 4,5-Disubstituted Oxazoles Marcus Baumann, Ian R. Baxendale, Steven V. Ley, Christoper D. Smith, and Geoffrey K. Tranmer Org. Lett.; 2006; 8(23) pp 5231 - 5234; (Letter) doi:10.1021/ol061975c
- ^ Ceric Ammonium Nitrate Promoted Oxidation of Oxazoles David A. Evans, Pavel Nagorny, and Risheng Xu Org. Lett.; 2006; 8(24) pp 5669 - 5671; (Letter) doi:10.1021/ol0624530
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

